Le leggi della termodinamica e la loro descrizione
Le leggi della termodinamica sono anche chiamate i suoi inizi. In realtà, l'inizio della termodinamica non è altro che una combinazione di quelli o di altri postulati che sono alla base della sezione pertinente della fisica molecolare. Queste disposizioni sono state stabilite durante la ricerca scientifica. Allo stesso tempo, sono stati provati sperimentalmente. Perché le leggi della termodinamica vengono prese per i postulati? Il fatto è che in questo modo la termodinamica può essere costruita assiomaticamente.

Leggi fondamentali della termodinamica
Un po 'di strutturazione. Le leggi della termodinamica sono divise in quattro gruppi, ognuno dei quali ha un significato specifico. Allora, cosa può dirci l'inizio della termodinamica?
Primo e secondo

Il primo inizio dice come applicare legge di risparmio energetico in relazione all'uno o all'altro sistema termodinamico. Il secondo inizio propone alcune restrizioni che si applicano alle direzioni dei processi termodinamici. Più specificamente, proibiscono il trasferimento spontaneo di calore da meno riscaldato a più caldo. Hai seconda legge della termodinamica e un nome alternativo: la legge dell'entropia crescente.
Ad
Terzo e quarto
La terza legge descrive il comportamento dell'entropia vicino alla temperatura assoluta zero. C'è un altro inizio, l'ultimo. Si chiama "legge zero della termodinamica". Il suo significato sta nel fatto che qualsiasi sistema chiuso arriverà ad uno stato di equilibrio termodinamico e non sarà in grado di uscirne da solo. Inoltre, il suo stato iniziale può essere qualsiasi cosa.
Perché abbiamo bisogno dell'inizio della termodinamica?
Le leggi della termodinamica sono state studiate per descrivere i parametri macroscopici di vari sistemi. Allo stesso tempo, non vengono avanzate proposte specifiche collegate a un dispositivo microscopico. Questa domanda è studiata separatamente, ma da un altro ramo della scienza - fisica statistica. Le leggi della termodinamica sono indipendenti l'una dall'altra. Cosa può significare? Deve essere compreso in modo tale che nessun inizio di termodinamica possa essere derivato da un altro.
Ad
La prima legge della termodinamica
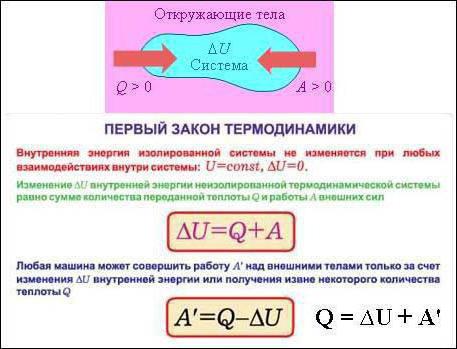
Come è noto, il sistema termodinamico è caratterizzato da diversi parametri, tra i quali vi è anche l'energia interna (indicata dalla lettera U). Quest'ultima è formata dall'energia cinetica che tutte le particelle hanno. Questa può essere l'energia della traslazione, oltre che vibrazionale e movimento rotatorio. A questo punto, ricordiamo che l'energia può essere non solo cinetica, ma anche potenziale. Quindi, nel caso di gas ideali energia potenziale trascurata. Ecco perché l'energia interna U sarà composta esclusivamente da energia cinetica i movimenti delle molecole e dipendono dalla temperatura.

Questa quantità, l'energia interna, è in altre parole chiamata funzione di stato, poiché è determinata dallo stato del sistema termodinamico. Nel nostro caso, è determinato dalla temperatura del gas. Va notato che l'energia interna non dipende da quale sia stata la transizione verso lo stato. Supponiamo che il sistema termodinamico esegua un processo circolare (un ciclo, come viene chiamato nella fisica molecolare). In altre parole, il sistema, dopo aver lasciato lo stato iniziale, subisce determinati processi, ma come risultato ritorna allo stato primario. Quindi non è difficile indovinare che il cambiamento nell'energia interna sarà uguale a 0.
Ad
Come cambia l'energia interna?
Ci sono due modi per cambiare l'energia interna di un gas ideale. La prima opzione è fare il lavoro. Il secondo è informare il sistema dell'una o dell'altra quantità di calore. È logico che il secondo metodo coinvolga non solo il messaggio di calore, ma anche la sua rimozione.
La formulazione della prima legge della termodinamica
Possono esserci molti di loro (formulazioni), poiché a tutti piace parlare in modo diverso. Ma in effetti, l'essenza rimane la stessa. Si riduce al fatto che la quantità di calore che è stata fornita al sistema termodinamico è spesa per eseguire un lavoro meccanico con un gas ideale e cambiare l'energia interna. Se parliamo della formula o della registrazione matematica della prima legge della termodinamica, allora si presenta così: dQ = dU + dA.
- Tutti i valori che fanno parte della formula possono avere segni diversi. Nulla impedisce loro di essere negativi. Supponiamo che la quantità di calore Q sia fornita al sistema, quindi il gas si surriscalda. La temperatura aumenta, il che significa che anche l'energia interna del gas aumenta. Cioè, sia Q che U avranno valori positivi. Ma se l'energia interna del gas aumenta, inizia a comportarsi in modo più attivo, espandersi. Pertanto, il lavoro sarà anche positivo. Possiamo dire che il lavoro è svolto dal sistema stesso, il gas.
Ad
- Se viene prelevata una certa quantità di calore dal sistema, l'energia interna diminuisce e il gas viene compresso. In questo caso, possiamo già dire che il lavoro è fatto sul sistema, e non su se stesso. Supponiamo di nuovo che alcuni sistemi termodinamici eseguano un ciclo. In questo caso (come detto prima) il cambiamento nell'energia interna sarà pari a 0. Pertanto, il lavoro svolto da o sopra il gas sarà numericamente uguale al calore fornito o assegnato al sistema.
- La registrazione matematica di questo effetto è chiamata un'altra formulazione della prima legge della termodinamica. Approssimativamente come segue: "In natura, l'esistenza di un motore del primo tipo è impossibile, cioè un motore che eseguirà un lavoro che supera il calore ricevuto dall'esterno."
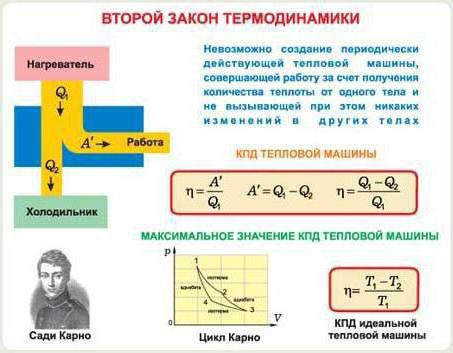
La seconda legge della termodinamica
Non è difficile immaginare che l'equilibrio termodinamico sia caratteristico di un sistema in cui le quantità macroscopiche rimangono invariate nel tempo. Questo, ovviamente, la pressione, il volume e la temperatura del gas. La loro immutabilità può essere costruita su diverse condizioni: l'assenza di conduttività termica, reazioni chimiche, diffusione e altri processi. Se, sotto l'influenza di fattori esterni, il sistema derivasse dall'equilibrio termodinamico, esso ritornerà nel tempo. Ma se questi fattori sono assenti. E succederà spontaneamente.

Andremo in un modo leggermente diverso da quello consigliato da molti libri di testo. Per cominciare, diamo un'occhiata alla seconda legge della termodinamica, e poi vedremo quali sono i valori che ci sono dentro e cosa significano. Quindi, in un sistema chiuso, in presenza di processi che si verificano in esso, l'entropia non diminuisce. La seconda legge della termodinamica è registrata come segue: dS> (=) 0. Qui, il segno> sarà associato a un processo irreversibile e il segno = sarà associato a uno reversibile.
Ad
Quello che viene chiamato un processo reversibile in termodinamica? E questo è un processo in cui il sistema restituisce (dopo una serie di alcuni processi) al suo stato originale. Inoltre, in questo caso, non rimangono modifiche nel sistema o nell'ambiente. In altre parole, un processo reversibile è un processo per il quale è possibile ritornare allo stato iniziale attraverso stati intermedi identici al processo diretto. Nella fisica molecolare tali processi sono pochissimi. Ad esempio, il trasferimento di calore da un corpo più caldo a uno meno caldo sarà irreversibile. Allo stesso modo, nel caso della diffusione di due sostanze, così come la distribuzione del gas all'intero volume.
entropia
L'entropia che si verifica nella seconda legge della termodinamica è uguale alla variazione della quantità di calore divisa per la temperatura. Formula: dS = dQ / T. Ha certe proprietà.