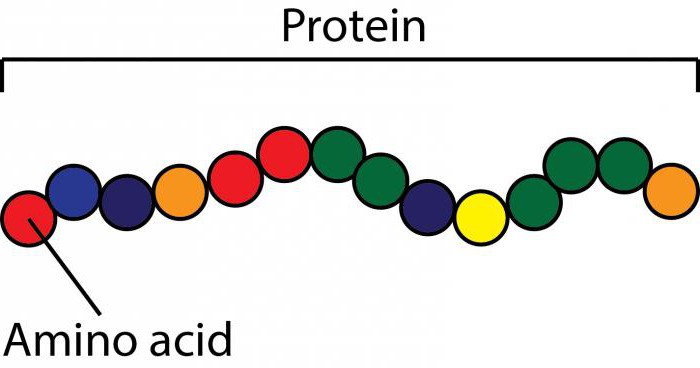
La denaturazione è il processo di modifica della struttura di una proteina.
La denaturazione è il processo di perdita della conformazione tridimensionale che le molecole proteiche possiedono. Un tale fenomeno può essere temporaneo o permanente. In ogni situazione, la sequenza di residui di amminoacidi in struttura proteica salvato.
Caratteristiche speciali
La denaturazione delle proteine è associata a un cambiamento di temperatura. Nel caso di rottura di un numero significativo di legami che stabilizzano la struttura spaziale di una molecola proteica, che è unica, la molecola completamente (o in una forma parziale) assumerà la forma di una spirale casuale casuale.
La denaturazione reversibile comporta cambiamenti parziali che non portano ad un cambiamento completo nella sequenza di amminoacidi primaria. In caso di completa distruzione è impossibile ripristinare la struttura della proteina.
Ad
caratteristica
Quando il biopolimero viene riscaldato a 60-80 gradi Celsius o esposto ad altri reagenti che possono distruggere i legami non covalenti (idrogeno, disolfuro) nelle proteine, si verifica la denaturazione.
Questo fenomeno si osserva all'interfaccia delle due fasi. In ambiente alcalino o acido, così come sotto l'influenza di solventi polari organici (fenoli, alcoli), la struttura della proteina viene distrutta.
meccanismo
In alcuni casi, essi usano per denaturare l'urea o il cloruro di guanidina, che sono in grado di formare legami idrogeno con gruppi carbonilici o amminici delle specie peptidiche, nonché con una parte dell'amminoacido radicale.
Allo stesso tempo, sostituiscono i legami idrogeno intramolecolari presenti nella molecola proteica, il che porta a un cambiamento nella struttura secondaria e terziaria dei biopolimeri. La denaturazione delle proteine dipende dalla presenza di legami disolfuro nella molecola.
Ad
Ad esempio, ponti disolfuro sono presenti nell'inibitore trypsan (proteina pancreatica). Quando vengono ripristinati, la denaturazione viene eseguita senza l'uso di altri componenti denaturanti. Quando la proteina viene successivamente posta in condizioni ossidative, i gruppi SH della cisteina vengono ossidati.
Come risultato dell'interazione chimica, la conformazione iniziale viene ripristinata. La presenza di un legame disolfuro contribuisce ad un aumento significativo della stabilità dell'intera struttura spaziale.
La denaturazione è un processo che porta a una diminuzione della solubilità di una molecola proteica. Come risultato della sua formazione di proteine "arricciate" di sedimenti. Ad alta concentrazione in una soluzione di un biopolimero si osserva una completa "coagulazione" della massa della soluzione.
Un esempio di tale fenomeno sarebbero le trasformazioni osservate durante la bollitura di un uovo di gallina. La denaturazione del DNA comporta la completa perdita dell'attività biologica di una proteina. Queste proprietà hanno contribuito all'utilizzo di una soluzione come antisettico. acido carbolico.
L'alta probabilità di distruzione della struttura delle molecole proteiche crea un enorme numero di difficoltà nel loro isolamento, studio, uso pratico per scopi industriali e medici.
rinaturazione
Se la denaturazione è il processo di abbattere i biopolimeri, la rinaturazione è l'opposto. Il recupero della conformazione nativa della molecola proteica è possibile in caso di raffreddamento lento della proteina distrutta durante il riscaldamento.
Ad
Un fenomeno simile conferma la struttura della struttura primaria delle molecole proteiche. La formazione di una conformazione nativa è un processo spontaneo che comporta l'uso di una quantità minima di energia.
La struttura spaziale del biopolimero utilizza la codifica della posizione della sequenza amminoacidica nel polipeptide. Questo complica la procedura di rinaturazione delle molecole proteiche.

conclusione
Le molecole proteiche con la stessa o simile conformazione possono avere differenze significative nella struttura primaria. Allo stesso tempo, gli amminoacidi diversi sono simili nelle caratteristiche chimico-fisiche delle catene laterali. Nel processo di denaturazione, la molecola si sviluppa, perde la capacità di soddisfare il suo scopo biologico.
Quando si verificano radiazioni ultraviolette o infrarosse energia cinetica biopolimero, risultante nella vibrazione dei suoi atomi. Ciò causa la completa distruzione dei legami di idrogeno, provoca la coagulazione della molecola proteica.