Proteina fibrillare: struttura, esempi
In termini di piegamento nello spazio tridimensionale, si distinguono due grandi gruppi di proteine: globulari e fibrillari. La maggior parte delle proteine appartiene alla prima frazione, che corrisponde a un modello tipico di una struttura terziaria, che descrive la catena degli amminoacidi come un groviglio sferico con un centro idrofobo e una superficie idrofila. Le proteine fibrose sono un gruppo specifico caratterizzato dalla forma filamentosa delle molecole.
Caratteristiche generali della struttura spaziale della proteina
Nella sua forma originale, la proteina sintetizzata è una catena lineare di amminoacidi collegati tra loro da legami peptidici. Tuttavia, sulla strada verso la forma funzionale finale, la molecola subisce diverse fasi di piegatura spaziale a causa di varie interazioni chimiche. Ogni fase della formazione è designata dalle strutture corrispondenti: primaria, secondaria, terziaria e quaternaria (se esiste).
Ad
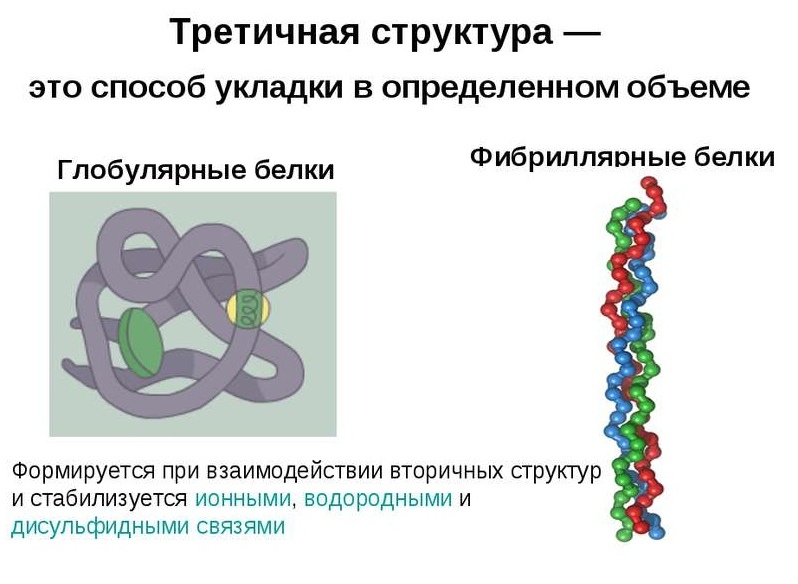
Le proteine globulari sono caratterizzate da una conformazione spaziale tridimensionale, che è trattenuta da un complesso di legami chimici deboli (idrogeno, ionico, idrofobo, ecc.). La forma della molecola di tale proteina assomiglia a un groviglio sferico.
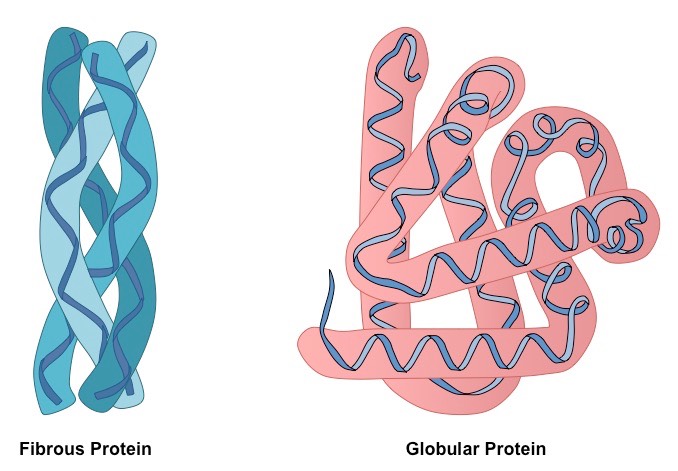
Le catene polipeptidiche di proteine fibrillari formano fibre lunghe, che consistono in elementi ripetitivi della struttura secondaria. Il dispositivo di conformazione terziaria delle proteine filamentose rispetto al globulo è molto più primitivo, tuttavia fornisce una buona stabilità.
Le principali differenze delle proteine filamentose da quelle sferiche
Oltre alla forma spaziale, le proteine fibrillari differiscono da quelle globulari in:
- dimensioni;
- solubilità;
- funzioni.
Le proteine fibrose sono generalmente più grandi di quelle sferiche e sono lunghe barre formate da spirali. A differenza delle proteine globulari, la conformazione spaziale di quelle fibrillari è fornita da forti legami a idrogeno. Per questo motivo, le proteine fibrose sono più stabili e non altrettanto facilmente denaturate come sferiche.
A differenza delle proteine globulari, fibrillare:
- non solubile in acqua, così come acidi e basi deboli;
- solubile in alcali forti e acidi;
- possedere le proprietà di estensibilità e compressione;
- caratterizzato da elevata resistenza agli enzimi digestivi.
Le proteine globulari sono costruite da sezioni diritte di strutture secondarie che, una volta combinate tra loro, cambiano drasticamente direzione, formando un groviglio tridimensionale. Le proteine fibrose sono costituite da un elemento, ripetuto molte volte.
Caratteristiche delle proteine fibrillari
La varietà di proteine fibrillari è significativamente inferiore a quella globulare. Questo gruppo è una frazione specializzata di proteine che svolgono principalmente funzioni strutturali. In questo caso, le proteine fibrillari lavorano a livello macro, formando grandi complessi supramolecolari.
Ad
Le proteine fibrose sono state identificate solo negli animali. Queste proteine svolgono la funzione di componenti di supporto di alcuni tessuti. Un tale ruolo biologico impone requisiti maggiori alla forza e all'ordine della costruzione delle molecole. Per questo motivo, la struttura fibrillare della proteina è più stabile del globulo.
Le proteine fibrose sono coinvolte nella formazione di strutture rigide, come:
- tessuto connettivo;
- tendini;
- fibre muscolari.
Queste proteine fanno parte di varie formazioni superficiali (epidermide, capelli, lana, ecc.), Svolgono funzioni protettive.
Nell'ambiente fisiologico naturale, le proteine fibrillari non sono presenti nella soluzione. Tuttavia, se mescoli artificialmente le molecole proteiche fibrose con l'acqua, si forma una massa molto viscosa.
Esempi di proteine fibrillari e globulari
Le proteine globulari comprendono tutte le proteine disciolte nei media intercellulari e intracellulari, nonché nel plasma sanguigno. Questi includono enzimi, ormoni proteici, fattori di trascrizione, immunoglobuline e così via. Un classico esempio di una proteina globulare può essere chiamato emoglobina.
Ad
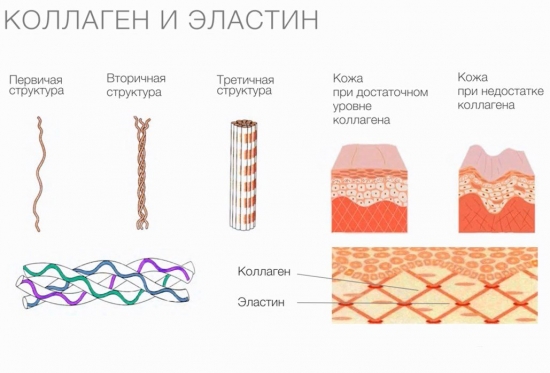
Le proteine sferiche svolgono molte funzioni, mentre le proteine fibrose - solo strutturali. Esempi tipici di proteine fibrillari sono il collagene, l'elastina e le cheratine. Il gruppo di proteine fibrose comprende anche la fibroina, di cui il filo di seta è costituito, e la fibrina, che si forma durante la polimerizzazione del fibrinogeno nel processo di coagulazione del sangue.
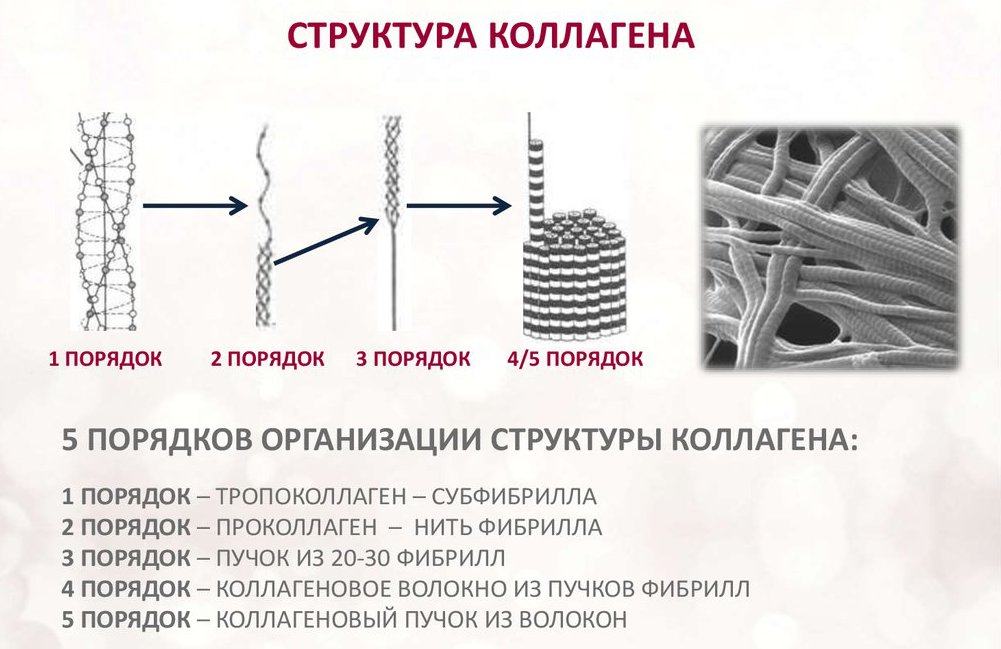
collagene
Il collagene è la proteina fibrillare più comune negli animali multicellulari. Fa parte del tessuto connettivo, garantendo la sua forza e le sue proprietà elastiche. Questa proteina è presente in:
- cartilagine;
- derma;
- tendini;
- matrice ossea organica;
- pareti delle navi;
- materiale osseo organico.
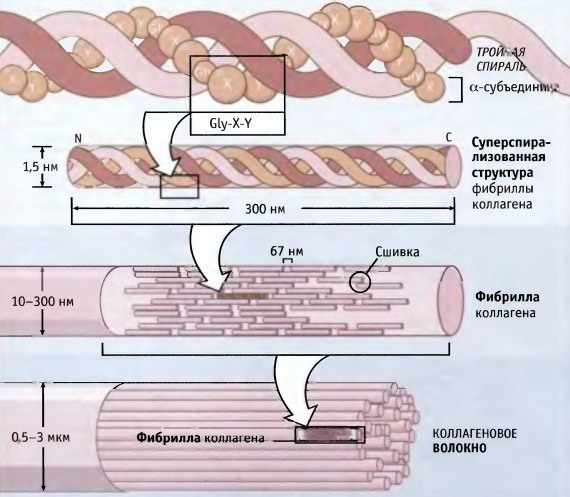
Il collagene consiste di tre catene di amminoacidi intrecciate a spirale e collegate l'una all'altra da legami covalenti. Le unità strutturali di questa proteina sono chiamate tropocollageni. Questi ultimi sono collegati l'un l'altro da estremità che sono sfalsate l'una dall'altra di una distanza di 67 nanometri.
A seconda della localizzazione nel corpo, ci sono 28 tipi di collagene. Tutte le varietà devono avere almeno un dominio a tripla elica. Il collagene costituisce la base di tutti i tipi di tessuto connettivo. I componenti strutturali di questa proteina formano fibrille molto forti che sono in grado di sopportare carichi considerevoli.
Ad
Il collagene svolge funzioni di sostegno e protezione e fornisce elasticità ai tessuti. Tuttavia, le molecole di questa proteina non hanno la capacità di allungare. Le proprietà gommose sono caratteristiche di un'altra proteina, presente anche nei tessuti connettivi, l'elastina.
cheratine
Esistono 2 tipi principali di cheratina: alfa e beta. Il primo gruppo comprende proteine fibrose che fanno parte delle formazioni di copertura dei vertebrati. I cherateni alfa costituiscono la maggior parte della massa secca:
- epidermide;
- capelli e lana;
- artigli e unghie;
- zoccoli, corna, conchiglie, aghi, ecc.
In altre parole, le cheratene alfa gruppo sono la base strutturale per la formazione di derivati della pelle. Una variante beta di questo tipo di proteina fibrosa si trova nella composizione del tessuto e della seta. Queste cheratine sono più morbide.
Le dure proteine alfa-gruppo svolgono funzioni protettive e assicurano anche la forza di alcune parti anatomiche (corna, zoccoli, becchi). A causa della cheratina, si verifica la formazione di calli sulla pelle danneggiata.
Ad
elastina
L'elastina è la principale componente proteica dei tessuti che dovrebbe avere elevate proprietà plastiche. Questa proteina fa parte di:
- arterie;
- polmoni;
- pareti della vescica;
- cuoio;
- legamenti elastici;
- cartilagine.
Come altre proteine fibrillari, l'elastina è costruita da unità ripetitive elementari. In questo caso agiscono come piccole molecole che pesano 65 kilodalton, che sono reticolate per formare un complesso insolubile. Ogni unità strutturale è chiamata protoelastina.