Modello quantomeccanico dell'atomo e sua struttura
Il modello planetario di meccanica quantistica dell'atomo di Bohr viene spesso ricordato per la sua immagine pulita e familiare degli elettroni. Ruotano attorno al nucleo centrale, come i pianeti attorno al sole. Per questo motivo, può essere difficile sostituire l'immagine di quella che rappresenta più accuratamente il modello quantomeccanico dell'atomo usato dai fisici moderni.
Come si muove e si muove l'atomo?
L'atomo ha un nucleo minuscolo e onde di orbite affilate. La posizione e il movimento degli elettroni sono descritti dalle onde della loro materia. Queste strutture predicono la probabilità di trovare un elettrone in una data regione di un atomo. Ma da dove viene il modello quantomeccanico dell'atomo di Bohr?
Il modello planetario ha avviato il processo di introduzione della teoria dei quanti nella struttura dell'atomo. Bohr ha introdotto l'idea di stati stazionari in cui l'atomo era stabile. Le transizioni tra questi stati hanno spiegato l'esistenza di linee spettrali. Nel caso dell'idrogeno, è stato in grado di ottenere livelli di energia:
Ad
- Le transizioni tra i suoi livelli di energia corrispondevano a linee nello spettro dell'idrogeno.
- Il suo modello non poteva prevedere i livelli di energia per altri atomi (sebbene i livelli di metalli alcalini simili all'idrogeno potessero essere avvicinati alla verità).
Separatamente, il lavoro di Heisenberg e Schrödinger è stato effettuato allo scopo di inventare modi per descrivere più dettagliatamente i livelli di energia quantizzata degli atomi.
Analogie di Heisenberg e Schrödinger: come hanno portato l'equazione alla prova di un'onda
Il modello quantum-meccanico della struttura dell'atomo ha un insieme unico di proprietà. Heisenberg usava matrici e Schrödinger sviluppò l'equazione delle onde per dimostrare l'assolutezza della differenza nel comportamento di un quanto. La dualità delle particelle è mostrata in modo più dettagliato nel video.
Ad

Le equazioni di Schrödinger forniscono una rappresentazione della densità di probabilità degli elettroni attorno al nucleo di un atomo. La maggior parte delle definizioni di teoria quantistica e meccanica quantistica offrono la stessa descrizione per entrambi. Descrivono essenzialmente la teoria quantistica, in cui sia l'energia che la materia hanno le caratteristiche delle onde in alcune condizioni e le caratteristiche delle particelle negli altri.
Per rendere l'idea più chiara, le persone hanno iniziato a condurre esperimenti in termini di promessa mentale.

- La teoria quantistica suggerisce che l'energia arriva in pacchetti discreti chiamati quanta (o, nel caso di radiazioni elettromagnetiche, fotoni).
- La teoria quantistica ha uno sviluppo matematico, spesso chiamato meccanica quantistica, che offre spiegazioni sul comportamento degli elettroni all'interno delle nubi di elettroni degli atomi.
Le principali disposizioni del modello quantistico della struttura dell'atomo sono la dualità delle onde di elettroni nella nuvola di elettroni, che limita la nostra capacità di misurare simultaneamente l'energia e la posizione dell'elettrone.
Caratteristiche nascoste di elettroni
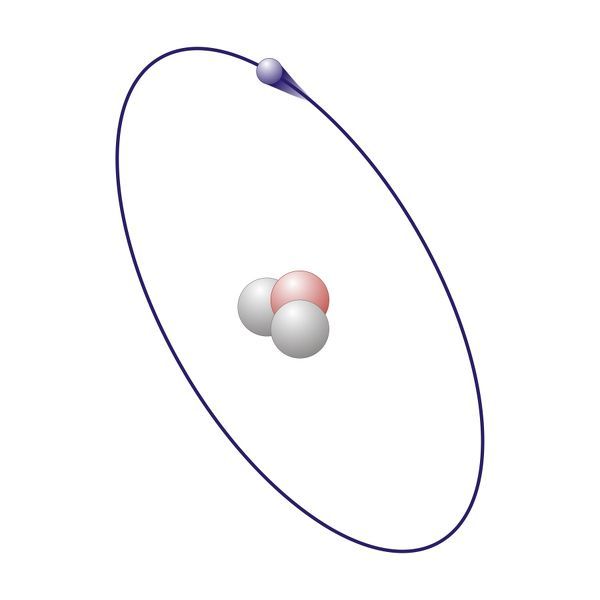
Quanto più accuratamente misuriamo l'energia o la posizione di un elettrone, tanto meno conosciamo l'altro. Non possiamo tracciare con precisione la posizione e la quantità di moto dell'elettrone allo stesso tempo. Questo rende impossibile prevedere la traiettoria di una particella. Di conseguenza, il comportamento di un elettrone è descritto in modo diverso rispetto al comportamento di particelle di dimensioni normali. Bisogno di sapere:
- Il modo più comune per descrivere gli elettroni negli atomi secondo la meccanica quantistica è quello di risolvere l'equazione di Schrödinger per gli stati energetici degli elettroni in questa nuvola.
- Quando un elettrone si trova in questi stati, la sua energia è chiaramente definita e la posizione non lo è.
- La posizione è descritta da una mappa di distribuzione di probabilità, chiamata orbitale.
La traiettoria che normalmente associamo agli oggetti macroscopici è sostituita da elettroni in nuvole di elettroni, e le descrizioni statistiche indicano non il percorso, ma l'area in cui si trova. Poiché è l'elettrone nella nuvola di elettroni atomici che determina il suo comportamento chimico, per comprendere la chimica, è necessario descrivere la configurazione degli elettroni nella chiave del modello quantistico dell'atomo.
Principio di indeterminazione di Heisenberg: l'area all'interno dell'atomo
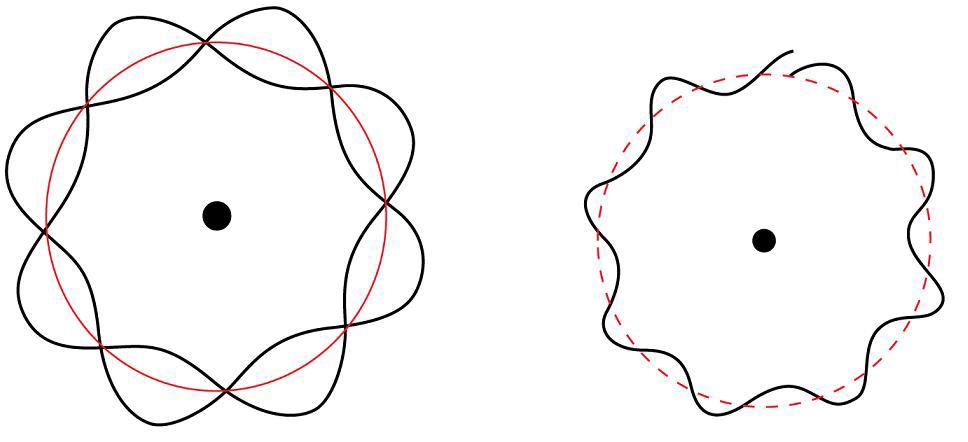
Louis de Broglie propose che tutte le particelle potessero essere considerate come onde materiali con una lunghezza d'onda - lambda, definita dalla seguente equazione:
Lambda = tempo effettivo (ora) + millivolt ora
Erwin Schrödinger propose un modello quantomeccanico dell'atomo. In breve: tratta gli elettroni come onde di materia.
Il quadrato della funzione d'onda rappresenta la probabilità di trovare un elettrone in una data regione all'interno di un atomo. L'orbita atomica è definita come la regione all'interno dell'atomo che è dove si trova l'elettrone.
Il principio di indeterminazione di Heisenberg afferma che non possiamo conoscere né l'energia né la posizione di un elettrone. Pertanto, quando impariamo di più sulla posizione di un elettrone, ne sappiamo meno sulla sua energia e viceversa. Gli elettroni hanno una proprietà intrinseca chiamata rotazione. Qualsiasi due elettroni che occupano la stessa orbita deve avere spin opposti.
Ad
L'etere luminifero nel mondo quantico
La natura della luce è stata oggetto di ricerca fin dall'antichità. Nel diciassettesimo secolo, Isaac Newton condusse esperimenti con lenti e prismi. È stato in grado di dimostrare che la luce bianca consiste di singoli colori dell'arcobaleno, combinati insieme. Newton ha spiegato i risultati della sua ottica con una visione "corpuscolare" della luce, in cui la luce consisteva in flussi di particelle estremamente piccole che si muovevano a velocità elevate in conformità con le leggi del moto di Newton. Vale la pena notare:
Christian Huygens ha mostrato che i fenomeni ottici come la riflessione e la rifrazione possono essere ugualmente ben spiegati dal punto di vista della luce come onde che si muovono ad alta velocità attraverso un mezzo chiamato "etere luminifero". Permea l'intero spazio.
Ad
All'inizio del diciannovesimo secolo, Thomas Young dimostrò che la luce che passa attraverso fessure strette e ravvicinate crea schemi di interferenza che non possono essere spiegati dal punto di vista delle particelle newtoniane, ma possono essere facilmente interpretati dal punto di vista delle onde.
- Più tardi, nel diciannovesimo secolo, dopo che James Clerk Maxwell sviluppò la sua teoria della radiazione elettromagnetica e mostrò che la luce è una parte visibile dell'enorme spettro di onde elettromagnetiche, la vista della luce della particella divenne completamente screditata.
Oggi queste aree sono chiamate meccanica classica e elettrodinamica classica (o elettromagnetismo classico).
Come è progredita l'idea di introdurre nuovi concetti in fisica

Verso la fine del diciannovesimo secolo, gli scienziati vedevano l'universo fisico come composto approssimativamente da due aree separate:
- materia formata da particelle che si muovono secondo le leggi del moto di Newton;
- radiazione elettromagnetica costituita da onde controllate dalle equazioni di Maxwell.
I paradossi hanno portato alla struttura moderna del modello quantomeccanico dell'atomo di Schrödinger, che collega strettamente le particelle e le onde a un livello fondamentale, chiamato dualità della particella dell'onda, che ha sostituito la visione classica.
Onda discreta di Bohr: come si comportano gli spettri di emissione dell'idrogeno
Secondo il modello di Bohr, gli spettri di emissione di vari elementi contengono linee discrete. La regione visibile degli spettri di emissione dell'idrogeno può essere rappresentata utilizzando la tabella.
Ad
| Numero quantico di base | Numero di sottolivelli | Numero di elettroni |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 18 |
| 4 | 4 | 32 |
Questa è una rappresentazione schematica di quanti, dove è noto il numero di elettroni e livelli. Nella vita sotto vuoto, è impossibile dire con certezza che esiste un limite per i sottolivelli, ma non ci può essere più di 7. Spettri di emissione quantizzati indicano che gli elettroni possono esistere all'interno di un atomo solo a determinati raggi ed energie atomiche.

Costruendo un modello, Bohr ha derivato un'equazione che prevedeva correttamente vari livelli di energia in un atomo di idrogeno. Il modello della meccanica quantistica era adatto solo per rappresentare questo caso particolare. I livelli corrispondevano alle linee di emissione nello spettro della sostanza.
Modello di Bohr, che ha dimostrato sistemi di idrogeno a un elettrone
La velocità dell'elettrone al livello di energia dello stato fondamentale dell'idrogeno è 2,2 × 10 6 s ÷ m, dove s è la lunghezza, m è la massa. Possiamo sostituire una costante, così come la massa e la velocità dell'elettrone nell'equazione di de Broglie. Ma allo stesso tempo, non poteva spiegare la struttura elettronica degli atomi che conteneva più di un elettrone.
Se passiamo alla chimica, il modello quantomeccanico dell'atomo di idrogeno dovrebbe consistere solo di protoni. Quando si incontrano elettroni o neutroni, la particella inizia a comportarsi come un'onda. In altri casi, gli atomi di un'altra sostanza possono, indipendentemente dalla struttura, comportarsi come onde o particelle. In poche parole, il modello quantomeccanico dell'atomo di idrogeno è il dualismo materiale di un'onda, ma non una particella.
Sovrapposizione di onde l'una sull'altra: come i percorsi di intersezione degli atomi non si mescolano
Le onde radio di un telefono cellulare, i raggi X utilizzati dai dentisti, l'energia utilizzata per cucinare nel forno a microonde, il calore radiante degli oggetti caldi e la luce proveniente dallo schermo della TV sono tutte forme di radiazioni elettromagnetiche che mostrano un comportamento ondulatorio. È necessario ricordare:
- Un'onda è un'oscillazione o un movimento periodico che può trasferire energia da un punto all'altro dello spazio.
- Scuotendo la fine della corda si trasferisce energia dalla mano all'altra estremità della corda; il ciottolo che cade in uno stagno porta a onde che si propagano lungo la superficie dell'acqua; l'espansione dell'aria che accompagna il fulmine genera onde sonore (tuoni) che possono viaggiare per diverse miglia.
- In ognuno di questi casi, l'energia cinetica viene trasmessa attraverso la sostanza (corda, acqua o aria), mentre la sostanza rimane al suo posto.
Le onde non dovrebbero limitarsi a viaggiare attraverso la materia. Come ha mostrato Maxwell, le onde elettromagnetiche consistono in un campo elettrico, che oscilla nel tempo con un campo magnetico perpendicolare. Sono perpendicolari alla direzione del movimento. Queste onde possono passare attraverso un vuoto a una velocità costante di 2.998 × 108 m / s, dove c è la velocità della luce.