La struttura dei corpi gassosi, liquidi e solidi è breve
In determinate condizioni, tutta la materia sul pianeta Terra è presente in uno dei tre stati: gassoso, liquido o solido. C'è anche un quarto stato della materia, chiamato plasma. Considerare la questione della struttura dei corpi gassosi, liquidi e solidi, nonché la loro transizione da uno stato all'altro quando cambiano le condizioni esterne.
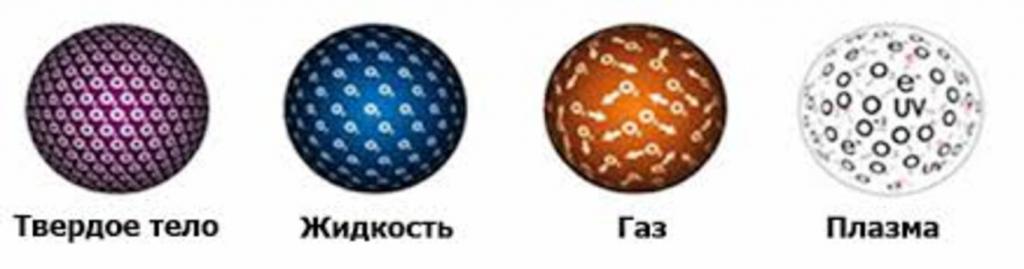
Stato solido della materia
I solidi sono caratterizzati dalla capacità di resistere alle forze esterne che li influenzano al fine di modificarne forma e volume. Considerando la questione della struttura di corpi gassosi, liquidi e solidi e di soffermarsi su questi ultimi, bisogna dire che le molecole in esse sono saldamente collegate l'una all'altra. Pertanto, l'oggetto ha una forma specifica, che conserva nelle stesse condizioni esterne.
Le molecole in un solido possono essere in uno stato ordinato, quindi parlano di una struttura cristallina. Oppure potrebbero essere in uno stato disordinato, quindi stiamo parlando di solidi amorfi. Esempio eclatante reticolo cristallino è la struttura dei sistemi metallici, che nello spazio forma un reticolo ideale di un tipo particolare, nei cui nodi ci sono ioni di atomi. Un esempio di un oggetto solido con una struttura amorfa è il vetro.
Ad

Scienza della materia solida
Solids studia diverse scienze, che includono quanto segue:
- Fisica della materia condensata. Studia materie solide e liquide, le cui dimensioni superano le 10 19 particelle, usando metodi sperimentali e teorici.
- Meccanica delle deformazioni. Questa scienza sta studiando proprietà meccaniche dei solidi come le sollecitazioni in esse, le deformazioni elastiche e plastiche, così come la connessione di queste proprietà con parametri esterni termodinamici. In questa disciplina la struttura della sostanza più dura non è importante.
- La scienza dei materiali. Studia già la struttura di molecole di corpi solidi, liquidi e gassosi, nonché transizioni di fase tra questi stati.
- Chimica allo stato solido. Questa disciplina è specializzata nella sintesi di nuovi materiali allo stato solido.
Alcune proprietà dei solidi
A pressione costante e temperature relativamente basse, la sostanza è allo stato solido. L'effetto di una piccola forza esterna su uno stato solido non porta a una deformazione esternamente visibile del solido.
Se aumenti la forza, il corpo inizierà a deformarsi elasticamente. Con un aumento ancora maggiore dell'esposizione esterna, sono possibili due opzioni:
- Se il corpo è un metallo, comincerà a subire deformazioni plastiche, cioè si verificheranno cambiamenti significativi nella sua forma, che rimarranno dopo la cessazione dell'influenza esterna.
- Se il corpo ha una struttura amorfa o una struttura cristallina, ma nei siti del reticolo ci saranno ioni di segni diversi, per esempio, il cristallo di sale di NaCl, quindi il corpo non si deformerà plasticamente, ma semplicemente collasserà.
Ogni corpo solido è caratterizzato da una certa densità. La sostanza più leggera di questa categoria è l'aerogel, la sua densità è di 3 kg / m 3 . Ma il materiale solido più denso noto all'umanità è il metallo - l'osmio. Un metro cubo di osmio ha una massa di 22.600 kg.
Ad
Materiali metallici
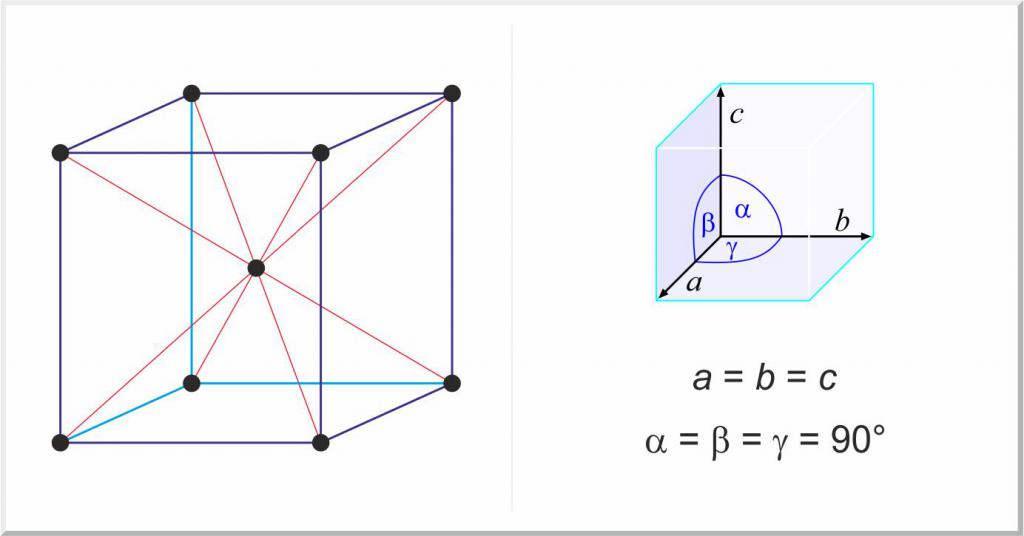
Un gruppo speciale di solidi sono i metalli puri e le loro leghe. In questo caso, la differenza nella struttura dei solidi dagli stati gassosi e liquidi della materia consiste nell'esistenza di un reticolo spaziale periodico, che è chiamato reticolo cristallino.

A causa della loro struttura cristallina, i metalli hanno una serie di proprietà importanti, ad esempio plasticità e diffrazione. Quasi tutti esistono in tre reticoli cristallini principali:
- cubo centrato sul viso, ad es. Au, Ag, Al, Cu;
- cubico centrato sul corpo, per esempio, Nb, Mo, W, Fe;
- Esagonale ben confezionato, ad esempio Ti, Zr.
La scienza della cristallografia è stata sviluppata per studiare le caratteristiche dei reticoli cristallini.
Materia condensata - liquido
Lo stato liquido così come lo stato solido è incomprimibile, cioè, mantiene il suo volume in una gamma considerevole di pressioni. Tuttavia, il liquido non mantiene la sua forma, che lo distingue da un solido e lo avvicina allo stato gassoso della materia.
Ad

Se le forze molecolari e atomiche agiscono nella formazione di solidi, allora il liquido è formato da molecole che sono collegate l'una all'altra solo da forze molecolari deboli. Il più comune sulla Terra è l'acqua, che, come il gas, può assumere la forma di una nave in cui è collocata.
Se parliamo della struttura di corpi gassosi, liquidi e solidi, va detto che un liquido, a differenza di un gas, non cambia la sua densità quando viene posto in una nave chiusa.
Caratteristiche specifiche del fluido
Per ciascun fluido, a causa della presenza di forze molecolari in esso, sono intrinseche proprietà quali tensione superficiale ed effetto capillare. Se una sostanza è nel campo della gravità, per esempio, della nostra Terra, allora qualsiasi corpo collocato in esso sarà espulso dal liquido secondo la famosa legge di Archimede.
Ad

Se la gravità non agisce sul liquido, la forza di galleggiamento sarà pari a zero. Inoltre, in assenza di forze esterne di sostanze in tale stato tende ad acquisire la superficie più piccola, riducendo così l'energia totale. Ecco perché, in condizioni di assenza di peso, le gocce d'acqua hanno una forma sferica, poiché la palla è la figura con la superficie più piccola per questo volume di liquido.
Le proprietà capillari sono spiegate dalla capacità delle molecole di entrare in relazione non solo l'una con l'altra, ma anche con gli atomi e le molecole di altri corpi. Queste caratteristiche fisiche del fluido sono chiamate rispettivamente coesione e adesione.
Parlando brevemente della struttura dei corpi gassosi, liquidi e solidi, dovremmo menzionare la proprietà della viscosità, che è inerente allo stato liquido e gassoso. La viscosità è la capacità di resistere a qualsiasi spostamento degli strati di una sostanza l'uno rispetto all'altro in presenza di un gradiente di pressione. Per i liquidi, questo indicatore dipende dalla velocità di spostamento di questi strati, dalla temperatura e dal peso molecolare. Maggiore è la velocità del corpo in un fluido, maggiore è il peso molecolare delle particelle fluide e minore è la temperatura, maggiore è la viscosità.
Ad
Struttura del gas
Il gas è uno stato di materia, quando le sue particelle costituenti non sono collegate da alcuna forza l'una con l'altra o queste forze sono molto deboli. Pertanto, tali sostanze cambiano liberamente il volume e la forma, riempiendo l'intera nave in cui sono collocati. Questa differenza nella struttura dei corpi gassosi da liquidi e solidi porta al fatto che hanno una densità inferiore. Nel caso di acqua gassosa, è comune parlare di vapore.

Non c'è alcun disordine assoluto nei gas reali. Tuttavia, le molecole in esso si muovono così velocemente che praticamente non interagiscono tra loro. Pertanto, il gas riempie assolutamente qualsiasi volume e le molecole in esso saranno separate da distanze relativamente grandi rispetto alle dimensioni delle molecole stesse. A causa della grande distanza tra le molecole, i gas si comprimono facilmente aumentando la loro densità e pressione interna.
Gas perfetto
In fisica, attraverso la creazione di modelli della struttura di corpi solidi, liquidi e gassosi, emergono alcune semplificazioni ragionevoli degli stati reali della materia, che rendono possibile l'uso di un apparato matematico più semplice per studiare questi stati. Uno di questi modelli era il concetto di un gas ideale.
Questo termine si riferisce allo stato gassoso di una sostanza in cui le molecole hanno dimensioni in punti rispetto alle distanze tra di loro e in cui non interagiscono tra loro.
In condizioni normali, cioè a pressione atmosferica e temperatura ambiente, la maggior parte dei gas reali può essere considerata ideale. Ad esempio, azoto, ossigeno, idrogeno, gas nobili, anidride carbonica e altri.
L'equazione di stato per un gas ideale è la seguente:
P * V = n * R * T, dove:
P, V, T e n - pressione, volume, temperatura e quantità di una sostanza gassosa, rispettivamente
R = 8,31 J / (mol * K) è la costante universale.
Il plasma è il quarto stato della materia
Quando si considera la struttura di corpi gassosi, liquidi e solidi nel decimo grado, si presta anche attenzione a un altro stato della materia: il plasma, che è un gas costituito da cationi e anioni, cioè particelle caricate positivamente e negativamente. Un primo esempio di plasma è la sostanza che costituisce il nostro sole.
Per un numero di proprietà, un plasma è simile a un gas, l'unica differenza è che è in grado di reagire ai campi magnetici, oltre a condurre una corrente elettrica. Il plasma può essere ottenuto riscaldando il gas a temperature elevate, in quanto ciò causerà collisioni tra le molecole, che porta alla loro ionizzazione parziale o completa.
Cambiamento nello stato della materia
Nella fisica di Classe 10, la struttura dei corpi gassosi, solidi e liquidi è considerata insieme alle transizioni tra questi stati. Le transizioni tra stati di sostanze sono possibili a causa di cambiamenti di pressione e temperatura. I cambiamenti si verificano solo nella struttura fisica dei corpi gassosi, liquidi e solidi e la loro composizione chimica rimane costante.
Sono possibili le seguenti transizioni tra diversi stati della materia:
- Fusione. Processo endotermico di transizione da solido a liquido.
- Cristallizzazione. Un processo esotermico in cui un liquido diventa solido durante il suo raffreddamento.
- Far bollire. Un processo endotermico fisico in cui un liquido entra in un gas.
- La condensa. Transizione esotermica di gas in liquido.
- Sublimazione o sublimazione Passaggio endotermico dal solido al gas, bypassando lo stato liquido. Un esempio classico è la sublimazione del ghiaccio secco.
Va notato che tutti i processi endotermici ed esotermici delle transizioni di fase procedono con una temperatura costante della sostanza. Tutti questi processi, la cui esistenza è dovuta alle peculiarità della struttura di corpi gassosi, liquidi e solidi, sono energetici, cioè richiedono o fornitura o rimozione di energia durante la loro attuazione.