Qual è il numero di Avogadro?
Legge Avogadro divenne una vera svolta nella chimica teorica e contribuì al fatto che ipotesi ipotetiche si trasformarono in grandi scoperte nel campo della chimica del gas. Le ipotesi dei chimici hanno ottenuto prove convincenti sotto forma di formule matematiche e relazioni semplici, ei risultati degli esperimenti ora hanno permesso di trarre conclusioni di vasta portata. Inoltre, un ricercatore italiano ha ricavato una descrizione quantitativa del numero di particelle strutturali di un elemento chimico. Il numero di Avogadro divenne successivamente una delle costanti più importanti della fisica e della chimica moderna. 
La legge delle relazioni volumetriche
L'onore di essere lo scopritore delle reazioni del gas appartiene a Gay-Lussac, uno scienziato francese della fine del XVIII secolo. Questo ricercatore ha dato al mondo una nota legge che governa tutte le reazioni legate all'espansione dei gas. Gay-Lussac ha misurato i volumi di gas prima della reazione e i volumi ottenuti a seguito dell'interazione chimica. Come risultato dell'esperimento, lo scienziato ha fatto una conclusione nota come la legge delle relazioni volumetriche semplici. La sua essenza è che i volumi di gas prima e dopo sono legati l'un l'altro come numeri interi.
Ad
Ad esempio, l'interazione di sostanze gassose, corrispondente, ad esempio, a un volume di ossigeno e due volumi di idrogeno, si traduce in due volumi di acqua vaporosa, e così via. 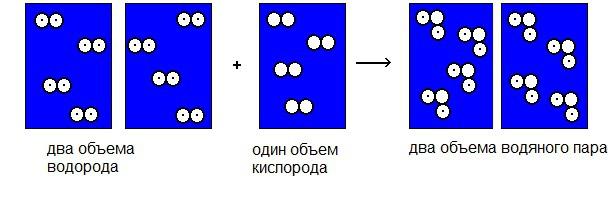
La legge Gay-Lussac è valida se tutte le misurazioni dei volumi si verificano alla stessa pressione e temperatura. Questa legge era molto importante per il fisico italiano Avogadro. Guidato da lui, derivò la sua ipotesi, che ebbe conseguenze di vasta portata in chimica e fisica del gas, e calcolò il numero di Avogadro.
Scienziato italiano
Le sue attività scientifiche Amedeo Avogadro Ha iniziato con lo studio dei fenomeni elettrochimici. Nel 1803, ha presentato il suo lavoro sulla teoria dei fenomeni elettrochimici propria dell'Accademia di Torino. Più tardi, le sue idee interessarono Ampere, che le sviluppò in una teoria fisica a pieno titolo, supportata da numerosi esperimenti. Interessato a tutte le ultime scoperte in fisica e chimica, Avogadro si è trovato ad affrontare il problema del rapporto tra i volumi di varie sostanze e il numero di molecole in essi contenute. Nel 1811, lo scienziato formulò un suggerimento che spiegava la legge di Gay-Lussac e diede un nuovo impulso alla spiegazione di molti reazioni chimiche
Ad
Legge Avogadro
Nel 1811, Avogadro arrivò alla conclusione che in uguali volumi di gas arbitrari a valori costanti di temperatura e pressione contiene lo stesso numero di molecole.  Questa legge, in seguito chiamata in onore dello scienziato italiano, introdusse nella scienza l'idea delle particelle più piccole di sostanza - le molecole. La chimica era divisa in scienza empirica, così com'era, e la scienza che opera in categorie quantitative, che è diventata. In particolare Avogadro ha sottolineato il fatto che gli atomi e le molecole non sono gli stessi e che gli atomi sono elementi costitutivi di tutte le molecole.
Questa legge, in seguito chiamata in onore dello scienziato italiano, introdusse nella scienza l'idea delle particelle più piccole di sostanza - le molecole. La chimica era divisa in scienza empirica, così com'era, e la scienza che opera in categorie quantitative, che è diventata. In particolare Avogadro ha sottolineato il fatto che gli atomi e le molecole non sono gli stessi e che gli atomi sono elementi costitutivi di tutte le molecole.
La legge del ricercatore italiano ha permesso di giungere alla conclusione sul numero di atomi nelle molecole di vari gas. Ad esempio, dopo la conclusione della legge Avogadro ha confermato l'ipotesi che le molecole di tali gas come l'ossigeno, l'idrogeno, il cloro e l'azoto siano costituite da due atomi. È diventato anche possibile stabilire le masse atomiche e le masse molecolari di elementi costituiti da diversi atomi.
Ad
Pesi atomici e molecolari
Nel calcolare il peso atomico di un elemento, inizialmente la massa di idrogeno è stata presa come unità di misura come la sostanza chimica più leggera. Ma le masse atomiche di molte sostanze chimiche sono calcolate come il rapporto tra i loro composti di ossigeno, cioè il rapporto tra ossigeno e idrogeno è stato preso come 16: 1. Questa formula era un po 'scomoda per le misure, quindi la massa dell'isotopo di carbonio, la sostanza più comune sulla terra, fu adottata come standard per la massa atomica.
Il principio di determinare le masse di varie sostanze gassose in equivalente molecolare si basa sulla legge Avogadro. Nel 1961 fu adottato un unico sistema di riferimento di valori atomici relativi, che era basato su un'unità convenzionale pari a 1/12 della massa di un singolo isotopo di carbonio 12 C. Il nome abbreviato dell'unità di massa atomica è Amu. Secondo questa scala, la massa atomica dell'ossigeno è 15.999 amu e quella del carbonio è 1.0079 amu. Quindi, è nata una nuova definizione: la massa atomica relativa è la massa di un atomo di una sostanza, espressa in amu.
Massa della molecola della sostanza
Qualsiasi sostanza è costituita da molecole. La massa di tale molecola è espressa in ae.u.m, questo valore è uguale alla somma di tutti gli atomi che compongono la sua composizione. Ad esempio, la molecola di idrogeno ha una massa di 2.0188 amu, ovvero 1.0079 x 2 e la massa molecolare di acqua può essere calcolata dalla sua formula chimica H 2 O. Due atomi di idrogeno e un singolo atomo di ossigeno danno un totale di 18 0152 amu
Ad
Il valore della massa atomica per ogni sostanza è chiamato peso molecolare relativo.
Fino a poco tempo fa, il termine "peso atomico" era usato al posto del termine "massa atomica". Attualmente non è usato, ma si trova ancora nei vecchi libri di testo e lavori scientifici.
Quantità unitaria di sostanza
Insieme alle unità di volume e massa, la chimica usa una misura speciale della quantità di una sostanza, chiamata talpa. Questa unità mostra la quantità di sostanza che contiene il maggior numero di molecole, atomi e altre particelle strutturali quanti sono in 12 g di carbonio dell'isotopo 12 C. Nell'applicazione pratica di una talpa di una sostanza, è necessario prendere in considerazione le particelle particolari degli elementi che si intendono - ioni, atomi o molecole. Ad esempio, la mole di ioni H + e le molecole di H 2 sono misure completamente diverse.
Attualmente, la quantità di una sostanza in una talpa di una sostanza viene misurata con grande precisione.
 I calcoli pratici mostrano che il numero di unità strutturali per mole è 6.02 x 10 23 . Questa costante è chiamata il numero di Avogadro. Prende il nome dallo scienziato italiano, questo valore chimico indica il numero di unità strutturali in una mole di qualsiasi sostanza, indipendentemente dalla sua struttura interna, composizione o origine.
I calcoli pratici mostrano che il numero di unità strutturali per mole è 6.02 x 10 23 . Questa costante è chiamata il numero di Avogadro. Prende il nome dallo scienziato italiano, questo valore chimico indica il numero di unità strutturali in una mole di qualsiasi sostanza, indipendentemente dalla sua struttura interna, composizione o origine.
Massa molare
La massa di una talpa di una sostanza in chimica è chiamata "massa molare", questa unità è espressa dal rapporto g / mol. Applicando il valore della massa molare in pratica, si può vedere che la massa molare dell'idrogeno è 2,02158 g / mol, ossigeno - 1,0079 g / mol, e così via.
Ad
Conseguenze della legge Avogadro
La legge di Avogadro è abbastanza applicabile per determinare la quantità di una sostanza quando si calcola il volume di gas. Un uguale numero di molecole di qualsiasi sostanza gassosa in condizioni uguali assume lo stesso volume. D'altra parte, 1 mole di qualsiasi sostanza contiene un numero invariato di molecole. La conclusione suggerisce se stessa: a temperatura e pressione costanti, una mole di sostanza gassosa occupa un volume costante e contiene un numero uguale di molecole. Il numero di Avogadro afferma che il volume di 1 mole di gas contiene 6,02 x 10 23 molecole.
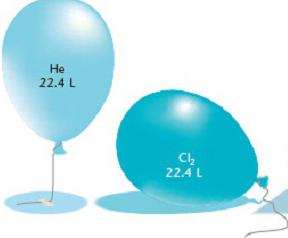
Calcola il volume di gas per condizioni normali
Condizioni normali in chimica - questa è una pressione atmosferica di 760 mm Hg. Art. e una temperatura di 0 o C. Con questi parametri, è stato stabilito sperimentalmente che la massa di un litro di ossigeno è 1,43 kg. Pertanto, il volume di una mole di ossigeno è pari a 22,4 litri. Nel calcolare il volume di qualsiasi gas, i risultati hanno mostrato lo stesso valore. Quindi la costante di Avogadro ha fatto un'altra conclusione riguardo ai volumi di varie sostanze gassose: in condizioni normali, una mole di qualsiasi elemento gassoso richiede 22,4 litri. Questo valore costante è chiamato il volume molare di gas.