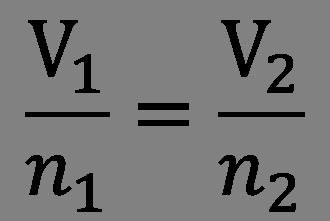La legge di Avogadro: descrizione e biografia di uno scienziato
Per anticipare i risultati dello studio, per prevedere il modello, per sentire le origini comuni - tutto questo ha segnato il lavoro di un gran numero di sperimentatori e scienziati. Molto spesso, la previsione si applica solo al campo di impiego del ricercatore. E pochi hanno il coraggio di fare previsioni a lungo termine, in anticipo sul tempo. L'italiano Amedeo Avogadro ha avuto abbastanza coraggio. È per questo motivo che questo scienziato è ora conosciuto in tutto il mondo. E la legge Avogadro è ancora usata da tutti i chimici e fisici del pianeta. In questo articolo descriveremo in dettaglio su di lui e il suo autore.
Infanzia e studio
Amedeo Avogadro è nato a Torino nel 1776. Suo padre, Philippe, lavorava come impiegato nel settore giudiziario. In totale, la famiglia ha avuto otto figli. Tutti gli antenati di Amedeo erano avvocati della Chiesa cattolica. Anche il giovane non si discostò dalla tradizione e prese la giurisprudenza. All'età di vent'anni aveva già un dottorato.
Nel tempo, la pratica legale ha cessato di attrarre Amedeo. Gli interessi del giovane si trovano in un'altra area. Anche nella sua giovinezza, ha frequentato la scuola di fisica sperimentale e geometria. Quindi, in futuro, lo scienziato ha svegliato l'amore per la scienza. A causa delle lacune nella conoscenza, Avogadro si è impegnato nell'autoeducazione. A 25 anni, Amedeo dedicò tutto il suo tempo libero allo studio della matematica e della fisica.
Attività scientifiche
Nella prima fase, il lavoro scientifico di Amedeo è stato dedicato allo studio dei fenomeni elettrici. L'interesse di Avogadro divenne particolarmente intenso dopo che la Volt scoprì la fonte di corrente elettrica nel 1800. Non meno interessante per il giovane scienziato furono le discussioni di Volta e Galvani sulla natura dell'elettricità. E in generale, quindi, quest'area era avanzata nella scienza.
Nel 1803 e nel 1804 Avogadro e suo fratello Felice presentarono due opere agli scienziati dell'Accademia di Torino, che rivelano teorie sui fenomeni elettrochimici ed elettrici. Nel 1804, Amedeo divenne un membro corrispondente di questa accademia.
Nel 1806, Avogadro ottenne un lavoro come tutor nel Liceo di Torino. Tre anni dopo, lo scienziato si trasferì al Liceo di Vercelli, dove insegnò matematica e fisica per dieci anni. A quel tempo, Amedeo leggeva molta letteratura scientifica, ricavandone utili estratti dai libri. Li ha portati alla fine della vita. C'erano ben 75 volumi di 700 pagine ciascuno. Il contenuto di questi libri parla della versatilità degli interessi dello scienziato e del lavoro colossale che ha svolto.
Vita personale
Amedeo sistemò la vita familiare abbastanza tardi, quando la sua età era già passata per la terza dozzina. Lavorando a Vercelli, conobbe Anna di Giuseppe, che era molto più giovane dello scienziato. In questo matrimonio sono nati otto figli. Nessuno di loro ha seguito le orme del padre.
La legge di Avogadro e le sue conseguenze
Nel 1808, Gay-Lussac (in collaborazione con Humboldt) formulò il principio delle relazioni volumetriche. Questa legge stabiliva che il rapporto tra i volumi di gas reagenti può essere espresso numeri primi Ad esempio, 1 volume di cloro, combinato con 1 volume di idrogeno, dà 2 volumi di acido cloridrico, ecc. Ma questa legge non ha dato nulla, perché, in primo luogo, non c'era alcuna differenza concreta tra i concetti di un corpuscolo, una molecola, un atomo e, in secondo luogo, gli scienziati avevano opinioni diverse sulla composizione delle particelle di vari gas.
Nel 1811, Amedeo iniziò un'analisi approfondita dei risultati della ricerca di Gay-Lussac. Di conseguenza, Avogadro ha capito che la legge delle relazioni di volume consente di comprendere la struttura della molecola del gas. L'ipotesi formulata diceva: "Il numero di molecole di qualsiasi gas nello stesso volume è sempre lo stesso."
Scoperta della legge
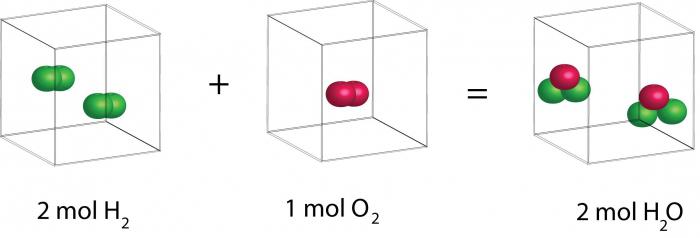
Per tre anni, lo scienziato ha continuato a sperimentare. E come risultato, apparve la legge Avogadro, che assomiglia a questo: "Uguali volumi di sostanze gassose alla stessa temperatura e pressione contengono lo stesso numero di molecole. Una misura della massa di molecole può essere determinata dalla densità di vari gas. " Ad esempio, se 1 litro di ossigeno contiene tante molecole quante 1 litro di idrogeno, il rapporto tra le densità di questi gas è uguale al rapporto di massa delle molecole. Lo scienziato ha anche notato che le molecole nei gas non sono sempre composte da singoli atomi. La presenza di atomi diversi e identici è accettabile.
Sfortunatamente, al momento di Avogadro, questa legge non poteva essere dimostrata teoricamente. Ma ha reso possibile stabilire in esperimenti la composizione delle molecole di gas e determinarne la massa. Seguiamo la logica di tale ragionamento. Durante l'esperimento, è stato trovato che il vapore acqueo da gas, così come i volumi di idrogeno e ossigeno sono correlati in un rapporto di 2: 1: 2. Da questo fatto, possiamo trarre conclusioni diverse. Il primo: una molecola d'acqua costituita da tre atomi e una molecola di idrogeno e ossigeno di due. Anche la seconda conclusione è appropriata: le molecole di acqua e ossigeno sono biatomiche e l'idrogeno è monatomico.
Avversari dell'ipotesi
La legge di Avogadro aveva molti avversari. Ciò era in parte dovuto al fatto che in quei giorni non esisteva una registrazione semplice e chiara delle equazioni e delle formule delle reazioni chimiche. Il principale nemico era Jens Berzelius, un chimico svedese di indiscussa autorità. Credeva che tutti gli atomi lo avessero cariche elettriche e le molecole stesse sono costituite da atomi con cariche opposte che si attraggono l'un l'altro. Quindi, gli atomi di idrogeno avevano una carica positiva e gli atomi di ossigeno ne avevano uno negativo. Da questo punto di vista, una molecola di ossigeno costituita da 2 atomi ugualmente caricati semplicemente non esiste. Ma se le molecole di ossigeno sono ancora monoatomiche, quindi nella reazione di azoto con ossigeno il rapporto del rapporto in volume dovrebbe essere 1: 1: 1. Questa affermazione contraddice l'esperimento, in cui sono stati ottenuti 2 litri di ossido nitrico da 1 litro di ossigeno e 1 litro di azoto. È per questo motivo che Berzelius e altri chimici rifiutarono la legge di Avogadro. Dopotutto, non è assolutamente coerente con i dati sperimentali.
Revival della legge
Prima degli anni sessanta del diciannovesimo secolo, l'arbitrarietà era osservata in chimica. E si è esteso come una valutazione pesi molecolari e sulla descrizione delle reazioni chimiche. C'erano generalmente molte idee sbagliate sulla composizione atomica delle sostanze complesse. Alcuni scienziati hanno addirittura pianificato di abbandonare la teoria molecolare. E solo nel 1858 un chimico italiano chiamato Cannizzaro trovò nella corrispondenza tra Berthollet e Ampere un riferimento alla legge di Avogadro e alle sue conseguenze. Questo ha razionalizzato l'intricata immagine della chimica del tempo. Due anni dopo, Cannizzaro ha parlato della legge Avogadro a Karlsruhe al Congresso Internazionale di Chimica. Il suo rapporto ha lasciato un'impronta indelebile sugli scienziati. Uno di loro disse che sembrava vedere i suoi occhi, tutti i dubbi svanirono, e in cambio apparve una sensazione di sicurezza.
Dopo aver riconosciuto la legge Avogadro, gli scienziati non solo hanno potuto determinare la composizione delle molecole di gas, ma anche calcolare le masse atomiche e molecolari. Questa conoscenza ha aiutato a calcolare i rapporti di massa dei reagenti in varie reazioni chimiche. Ed è stato molto comodo. Misurando la massa in grammi, i ricercatori potrebbero operare con le molecole.

conclusione
È passato molto tempo da quando è stata scoperta la legge di Avogadro, ma nessuno si è dimenticato del fondatore della teoria molecolare. La logica dello scienziato era impeccabile, che fu poi confermata dai calcoli di J. Maxwell basati sulla teoria cinetica dei gas, e quindi studi sperimentali (Moto browniano). È stato anche determinato il numero di particelle contenute in una mole di ciascun gas. Questa costante - 6.022 • 1023 è stata nominata Il numero di Avogadro perpetuando il nome del discernente Amedeo.