Proprietà anormali dell'acqua: cause, significato
Le persone sono abituate all'acqua e la considerano una sostanza ordinaria. Spesso lo danno per scontato fino a quando la siccità minaccia le colture e l'acqua potabile, o gravi alluvioni rappresentano una minaccia per la vita e la proprietà. Molti non si rendono conto che la struttura dell'acqua e le sue proprietà anomale assicurano l'esistenza della vita sulla Terra.
Uno dei primi filosofi greci, Talete di Mileto (640-546 aC E.), indagato sulla natura universale dell'acqua. Lo considerava l'elemento principale da cui nasce tutto. L'abbondanza di acqua era ovvia, ma Thales ha notato che è l'unica sostanza che è naturalmente presente sulla Terra nello stesso momento in tre diversi stati: solido, liquido e gassoso. In una fredda giornata invernale, neve e ghiaccio coprono i campi, un fiume scorre nelle vicinanze e le nuvole fluttuano sopra la testa.
Ad
Forme di materia
Tutte le sostanze esistono in tre stati diversi, che dipendono dalla temperatura e dalla pressione. I solidi hanno una certa forma e hanno una struttura interna cristallina. Con questa definizione, una sostanza come il vetro sarà considerata un liquido altamente viscoso, poiché non ha una struttura cristallina. I solidi tendono a resistere alle influenze esterne. Possono essere convertiti in liquidi riscaldando. Il punto di congelamento dell'acqua alla pressione di 1 atmosfera è 0 ° C, al di sotto del quale esiste come ghiaccio.
Un liquido, a differenza di un corpo solido, non ha fermezza e non ha una forma definita. Ha un volume e assume la forma di una nave in cui è conservato. L'influenza esterna lo costringe a fluire. L'acqua è un liquido tra temperature di congelamento e di ebollizione (100 ° C). I liquidi possono passare alla fase gassosa quando riscaldati sopra il punto di ebollizione.
Ad
Il gas non ha forma o volume. Prende forma e occupa il volume della nave in cui si trova. Il gas si espande e si contrae con i cambiamenti di temperatura e pressione e può facilmente diffondersi in altri gas.

Punti di ebollizione e congelamento
Le proprietà anormali dell'acqua sono le sue temperature insolitamente alte di ebollizione e congelamento rispetto ad altri composti con una struttura molecolare simile. Altre sostanze simili in condizioni normali sono gas. Si prevede che l'acqua con il suo peso molecolare più basso rispetto a composti simili abbia temperature di ebollizione e congelamento più basse. Tuttavia, a causa della natura polare della sua molecola e dei legami idrogeno, il suo punto di ebollizione è 100 ° C e il congelamento è 0 ° C. Per confronto, i valori corrispondenti per l'idrogeno solforato H 2 S sono -60 ° C e -84 ° C, per l'idrogeno solforato H 2 Se, questo indicatore è -42 ° C e -64 ° C e tellururo per -2 ° C e -49 ° C .
Fase solida
Di norma, con una diminuzione della temperatura, le sostanze diventano più dense e l'acqua non fa eccezione. La sua densità a 25 ° C è 0,997 g / ml e aumenta fino ad un massimo (1 g / ml) a T = 4 ° C. Nel sistema di misurazione metrica, un chilogrammo è definito come la massa di 1 litro di acqua con la massima densità. Una cosa sorprendente accade tra 4 ° C e il punto di congelamento di 0 ° C, che si osserva in un numero molto piccolo di sostanze. L'acqua si espande gradualmente, diventando meno densa. La densità del ghiaccio a 0 ° C è di circa 0,917 g / ml. Le molecole d'acqua formano cristalli nella forma di un tetraedro (una figura quadrilatera, ciascuna delle quali è un triangolo equilatero). Poiché la densità della fase solida è inferiore al liquido, il ghiaccio galleggia. Se congelato, il volume dell'acqua aumenta dell'1%.
Ad
È molto importante che il ghiaccio si espanda e galleggi sulla superficie. Per questo motivo, le tubature dell'acqua scoppiano in inverno e le buche appaiono sulle strade. Il congelamento e la fusione dell'acqua sono in gran parte responsabili della distruzione delle rocce e della formazione del suolo. Inoltre, se laghi e torrenti si congelassero verso l'alto, la vita acquatica in generale cesserebbe di esistere e le condizioni climatiche e climatiche cambieranno drasticamente.

Capacità di calore
Un'altra proprietà anormale dell'acqua è la sua capacità estremamente elevata di assorbire il calore senza un significativo aumento della temperatura. Ad esempio, il sole estivo sulla spiaggia riscalda la sabbia a tal punto che diventa impossibile camminarci sopra. L'acqua rimane fresca. Entrambe le sostanze assorbono una pari quantità di energia termica, ma la temperatura della sabbia è più alta. Una pentola di ferro vuota appesa sopra il fuoco risplenderà rapidamente incandescente, ma se viene riempita d'acqua, viene riscaldata gradualmente. L'elevata capacità termica dell'acqua ne fa un buon refrigerante nei condensatori e nei radiatori auto che impediscono il surriscaldamento dei motori. Il suo valore è 5 volte la capacità di calore della sabbia e circa 10 volte il ferro.
Ad
Il clima temperato nelle zone costiere è il risultato dell'assorbimento durante il giorno di un'enorme quantità di energia solare termica da parte dell'acqua e del suo lento rilascio durante la notte. Le aree interne lontane dalla costa di solito hanno temperature estreme molto più alte. Enormi oceani sulla Terra (circa il 75% della superficie) sono responsabili della mitigazione del clima sul nostro pianeta, sostenendo l'esistenza della vita.
Calore di fusione ed evaporazione
Il calore della transizione di fase è associato alla capacità termica. Questa è la quantità di energia termica assorbita o rilasciata da una sostanza che cambia in fase (da liquido a solido, o viceversa, e da liquido a gassoso, o viceversa) senza un cambiamento di temperatura. Valori insolitamente elevati di calore specifico di fusione (332,4 kJ / kg) e evaporazione (2256,2 kJ / kg) sono le seguenti proprietà fisiche anomale dell'acqua. Il congelamento produce la stessa quantità di calore che viene assorbita durante il processo di fusione.

Un esempio pratico di utilizzo del calore specifico di fusione dell'acqua è l'uso del ghiaccio per raffreddare le bevande in un dispositivo di raffreddamento isolato. Nel processo di fusione del ghiaccio assorbe l'energia termica delle bevande, mantenendole fredde. Un contenitore con acqua in una serra in una fredda notte invernale ammorbidisce la temperatura della stanza a causa del calore rilasciato durante il congelamento. La condensazione del vapore rilascia la stessa quantità di calore che viene assorbita durante il processo di evaporazione. Il calore specifico di evaporazione è 5 volte il calore necessario per aumentare la temperatura da 0 a 100 ° C. La proprietà anormale dell'acqua per immagazzinare una grande quantità di energia termica accumulata rende efficiente il riscaldamento a vapore. Nel processo di condensazione, il vapore rilascia l'energia termica accumulata. Un temporale diurno in una calda giornata estiva è un altro esempio del rilascio di energia termica nell'atmosfera superiore durante la condensazione di aria calda e umida. Anche un uragano è un esempio dell'effetto di ridistribuzione di enormi quantità di energia termica assorbita dagli oceani tropicali.
Ad
I sistemi di raffreddamento evaporativo funzionano diversamente. L'acqua nel processo di evaporazione assorbe l'energia termica dall'aria, raffreddandola.
Solvente universale
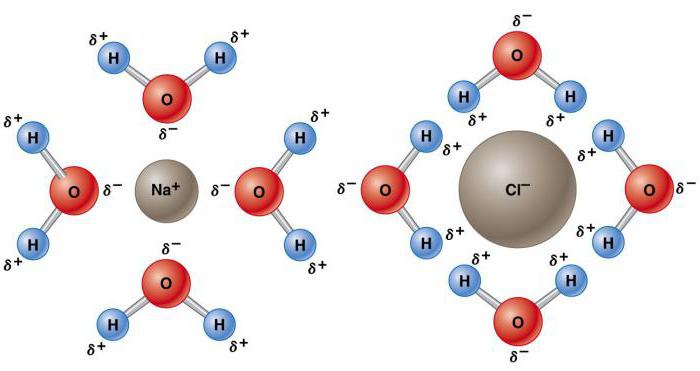
Il solvente è in grado di sciogliere un'altra sostanza con la formazione di una miscela omogenea (soluzione) a livello molecolare. Un'altra proprietà anormale dell'acqua in chimica a causa della sua natura polare è la sua capacità di dissolvere altri composti polari - sali, alcoli, composti carbossilici, ecc. Altre sostanze si dissolvono nell'acqua rispetto a qualsiasi altro solvente. Più della metà degli elementi chimici conosciuti possono essere trovati in esso, alcuni in alte concentrazioni e altri solo in tracce. Ad esempio, la concentrazione di saturazione del cloruro di sodio è di circa 36 g per 100 ml e il carbonato di calcio - circa 0,0015 g La capacità dell'acqua di sciogliere una sostanza dipende dalla sua composizione chimica, dalla forza dei legami chimici degli elementi, dalla temperatura e dal pH.
Composti non polari, compresa la maggior parte degli idrocarburi, si sciolgono in quantità basse o in tracce. Ad esempio, gli oli tendono a galleggiare sulla superficie dell'acqua.

Tensione superficiale
Le proprietà anormali dell'acqua includono la tensione superficiale più alta (dopo il mercurio) rispetto a qualsiasi altro liquido. Questa è la forza di attrazione delle molecole situate sotto la superficie e quelle situate all'interfaccia aria-liquido. Mantiene l'acqua dalla diffusione. I composti polari, di regola, hanno una tensione superficiale molto più elevata rispetto a quelli non polari. E l'acqua non fa eccezione. A 20 ° C, questo indicatore è pari a 0,07286 N / m (per alcol etilico - 0,0228 N / m).
Senza influenza esterna, la goccia di H 2 O assume la forma di una sfera, poiché questa figura ha l'area superficiale più piccola per unità di volume. Le gocce di pioggia sono minuscole pallottole che distruggono rocce. Per la stessa ragione, oggetti che sono più pesanti dell'acqua possono essere trattenuti sulla sua superficie. Gli insetti possono camminare su di esso e le lame del rasoio nuotare.
Il legame idrogeno determina la proprietà anomala dell'acqua per bagnare la maggior parte delle superfici. Tali sostanze sono considerate idrofile. L'acqua può salire lungo le pareti del vetro e altri contenitori. Altre sostanze, come oli, grassi, cere e materiali sintetici (polipropilene, ecc.) Non si bagnano. Sono idrofobi. Le cartucce filtranti a membrana con una dimensione dei pori inferiore a 1 micron sono fatte di polimeri idrofobi con l'aiuto di agenti bagnanti che riducono la tensione superficiale dell'acqua in modo che quest'ultima possa penetrare e rimanere in esse. Questo fenomeno è chiamato effetto capillare. È responsabile del movimento dell'acqua nel suolo e lungo le radici delle piante e del sangue attraverso i vasi sanguigni.

Proprietà anormali dell'acqua e la loro importanza per la vita
H 2 O è una componente integrale dell'esistenza di tutta la vita. Questo spiega il recente interesse a trovare acqua in altre parti dell'universo. Tutti i noti processi biochimici si verificano nell'ambiente acquatico. La maggior parte degli esseri viventi contiene il 70-80% di H 2 O in peso.
Inoltre, l'acqua svolge un ruolo significativo nel processo di fotosintesi. Le piante usano l'energia radiante del sole per convertire acqua e anidride carbonica in carboidrati: 6CO 2 + 6H 2 O + 672 kcal → C 6 H 12 O 6 + 6O 2 . La fotosintesi è la reazione chimica più fondamentale e importante sulla Terra. Fornisce sostanze nutritive, direttamente o indirettamente, a tutti gli organismi viventi ed è la principale fonte di ossigeno atmosferico.
Proprietà dell'acqua anormali e loro cause
La capacità degli elementi di formare composti dipende dalla capacità dei loro atomi di donare o accettare elettroni. Elementi del primo tipo diventano ioni caricati positivamente (cationi) e del secondo tipo - anioni caricati negativamente.
La capacità di un elemento di interagire con altri elementi per formare composti si chiama valenza. Corrisponde al numero di elettroni ricevuti o dati via. Per i composti inorganici, la somma algebrica dei numeri di valenza degli elementi è zero. Si chiama l'attrazione elettrostatica di ioni caricati opposti per formare un composto legame ionico.
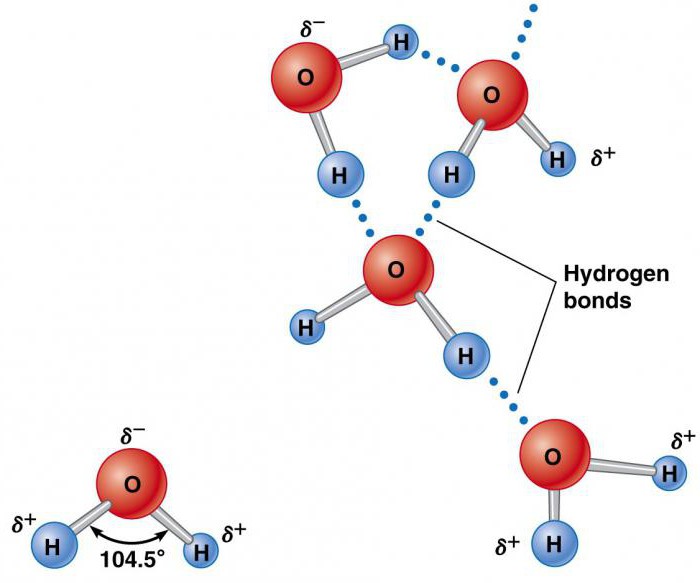
Gli elementi che formano l'acqua (idrogeno e ossigeno) esistono separatamente nelle molecole H 2 e O 2 che contengono ciascuno due atomi. Sono tenuti insieme dallo scambio di una coppia di elettroni in un legame chimico chiamato legame covalente. È molto più forte dello ione. Due atomi tenuti insieme legame covalente forma una molecola molto più stabile delle sue parti costituenti. In esso, l'idrogeno è combinato dall'ossigeno attraverso coppie di elettroni comuni. Questa esclusiva distribuzione di elettroni nel composto chimico risultante fa sì che gli atomi di H siano posizionati rispetto a O ad un angolo di 104,5 °.
Le proprietà fisiche anormali dell'acqua sono spiegate dalla sua struttura e dal legame chimico.
L'atomo di ossigeno ha un effetto relativamente forte sulla coppia totale di elettroni, con il risultato che gli atomi di idrogeno diventano elettropositivi e l'atomo di ossigeno la regione elettronegativa. Poiché le regioni caricate positivamente e negativamente sono distribuite in modo non uniforme rispetto al punto centrale, la molecola d'acqua è polare.
Tale sua natura lo rende elettrostaticamente attraente per altre molecole di H 2 O, così come ioni e superfici di contatto con regioni cariche. Gli atomi di idrogeno attivo sono attratti dagli atomi di ossigeno elettronegativi delle molecole d'acqua vicine. Questo fenomeno è chiamato legame idrogeno. La sua forza è di circa il 10% covalente, ma è responsabile della maggior parte delle proprietà fisiche anomale dell'acqua. Questi includono alti punti di congelamento e di ebollizione, capacità di calore, calore specifico di fusione ed evaporazione, solubilità e tensione superficiale.
Il legame idrogeno è responsabile del mantenimento dell'integrità della molecola di H 2 O durante le reazioni chimiche. Mentre altri composti subiscono la ionizzazione, l'acqua stessa mantiene la sua integrità chimica. Solo un numero relativamente piccolo di molecole viene ionizzato in idrogeno e ioni idrossile. Pertanto, H 2 O è un conduttore relativamente povero di corrente elettrica. La resistenza specifica di acqua teoricamente pura è 18,3 MΩ cm, mentre la resistenza al consumo ha una resistenza specifica inferiore a 10.000 ohm cm. In questo modo puoi facilmente controllare la purezza di H 2 O.
Le proprietà anomale dell'acqua sono spiegate dalla presenza di legami idrogeno, a causa del quale c'è una bassa densità di ghiaccio. Lungo di loro si trovano molecole di congelamento, che porta all'espansione della sostanza. Per questo motivo, il ghiaccio galleggia sulla superficie dell'acqua. L'aumento della pressione riduce il punto di fusione. La pressione creata dalla lama del pattino affoga il ghiaccio, creando uno strato che fornisce una planata elegante. Anche a temperature estremamente basse, l'alta pressione si indebolisce reticolo cristallino. Questo è il motivo per cui enormi masse di ghiaccio, come i ghiacciai, si stanno gradualmente spostando.
Momento di dipolo
La natura polare di una molecola d'acqua lo rende orientato in un campo elettrico o magnetico. L'atomo di ossigeno elettronegativo è allineato al polo positivo e gli atomi di idrogeno elettropositivo nella direzione negativa. L'acqua ha un momento di dipolo eccezionalmente grande, che è un prodotto della distanza tra le cariche moltiplicata per la quantità di carica.
La costante dielettrica è un'altra proprietà associata al momento di dipolo. Le molecole d'acqua allineandole in un campo elettrico tendono a neutralizzarlo e creano resistenza al trasferimento di una carica elettrostatica. La costante dielettrica di una sostanza è determinata da ε nell'equazione F = Q1 ∙ Q2 / ε ∙ r 2 , dove F è la forza tra due cariche Q, divisa per la distanza r nel mezzo.
All'aumentare della costante dielettrica, la forza tra le cariche diminuisce. Un'elevata costante dielettrica riduce la forza attrattiva degli ioni, il che spiega le proprietà chimiche anomale dell'acqua di dissolvere un'ampia varietà di sostanze.
conclusione
Per gli esseri umani, l'acqua è una sostanza comune che è spesso data per scontata. Nonostante il fatto che le proprietà anomale dell'acqua siano spiegate a livello atomico, il suo significato è davvero grande. Ovviamente, è necessario per l'esistenza della vita sulla Terra. Le proprietà anormali dell'acqua, in breve, le permettono di fungere da mediatore dei processi chimici e biochimici, di modellare il nostro ambiente naturale e di partecipare alla creazione di clima e clima.