Leggi di base della chimica. Concetti di base e leggi della chimica
Non sarà superfluo definire prima il termine " chimica " - questa è la scienza più importante che studia la struttura delle sostanze, le loro trasformazioni. Comprende i seguenti concetti e leggi di base (chimica):
1. Le proprietà chimiche di ogni sostanza sono stabilite sulla base dello stato dei gusci elettronici delle molecole (esterne), gli atomi che lo formano. I nuclei e gli elettroni interni rimangono quasi invariati durante i processi chimici.
2. Oggetto della chimica - elementi chimici, loro combinazioni (atomi, semplici, complessi: ioni, carbeni, radicali liberi, molecole, ioni radicali, nonché materiali, composti chimici, loro associazioni: cluster, clatrati, associati, solvati, ecc. ). Ce n'è un numero enorme, ed è in costante crescita a causa del fatto che questa scienza stessa costituisce il suo oggetto (circa 10 milioni di composti chimici sono già noti).
3. Una sostanza è un tipo di materia con una certa massa di riposo e costituita da particelle elementari quali elettroni, neutroni, protoni, mesoni, ecc. Questa scienza studia tali sostanze che vengono convertite in atomi, ioni, molecole e radicali. Sono: complessi, semplici (composti chimici).
4. Il componente più piccolo di un elemento chimico che non può essere separato chimicamente e che conserva tutte le proprietà originali definite dal guscio elettrico e la carica nucleare è chiamato atomo . La parte di una sostanza (composto) contenente atomi identici è chiamata elemento chimico , ognuno dei quali corrisponde a un complesso di certi atomi.
5. Una molecola è una microparticella che ha 2 o più atomi ed è capace di esistenza autonoma. Ha una costante composizione quantitativa e qualitativa dei nuclei atomici, nonché un numero costante di elettroni; dotato di proprietà uniche. 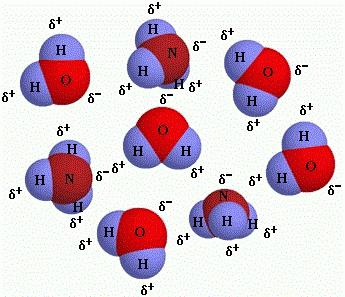
6. Le sostanze semplici sono formate da atomi di solo il 1 ° elemento chimico, in vista del quale sono una forma speciale del suo essere nello stato libero (O₂, H₂, He, O₃, S₈), e le sostanze complesse sono formate da diversi elementi chimici e possono avere una composizione costante ( daltonuri o composti stechiometrici) o variabile (berthollides o composti non stechiometrici).
7. Gli ioni sono particelle monoatomiche o poliatomiche con carica elettrica. Gli ioni caricati positivamente sono cationi e negativamente sono anioni. Sotto forma di gas, sono nel loro stato libero.
8. La valenza è la capacità di un atomo di sostituire o attaccare altri atomi (gruppi atomici) e di formare legami chimici. La misura di valenza è il numero di atomi di idrogeno (ossigeno) che sono collegati a un elemento chimico. L'idrogeno è monovalente e l'ossigeno è bivalente.
9. Le reazioni chimiche sono la trasformazione di alcune sostanze (composti iniziali) in sostanze di diverso tipo (prodotti di reazione), che non modificano i nuclei degli atomi.
10. Reagenti : materiali di partenza o uno dei composti di partenza più attivi, che determina la direzione della reazione. 
Origine del termine in questione
Ci sono 2 punti di vista sulla sua origine:
- Dal nome antico dell'Egitto - "Orlo", che letteralmente si traduce come "nero", scuro. " Presumibilmente a causa del colore del terreno della valle del r. Neil.
- Dal termine greco antico "chemeia" - la forma d'arte del metallo fuso.
Il nome moderno deriva dalla parola latina "chimia". È internazionale (per esempio, in chemie tedesco, in francese, in chimica inglese). È noto che l'antenato del termine "chimica" è l'alchimista greco Zosima (V sec.).
Chimica organica: definizione, composti organici
Questa è la scienza che studia i composti del carbonio che sono prodotti dagli organismi viventi. Ad oggi sono noti più di 2 milioni di composti organici, suddivisi in gruppi quali alcheni, alcoli, alcani, ecc. La maggior parte di essi sono inclusi nella composizione del petrolio e occupano posizioni di primo piano nella produzione di: coloranti, droghe, materie plastiche, cosmetici .
La composizione di composti organici: atomi di carbonio e altri elementi (ossigeno, idrogeno), che sono collegati da forti legami covalenti. I composti che si formano dagli atomi di carbonio con l'idrogeno sono chiamati idrocarburi .
Il principale componente del gas naturale è un semplice idrocarburo (metano - CH₄). La chimica organica esplora esattamente composti organici differenziato dalle famiglie e che sono chiamate serie omologhe .
I suddetti gruppi (alcheni, alcani) appartengono a diverse serie omologhe, ciascuna delle quali comprende migliaia di composti. La loro posizione in questa serie è determinata dal numero di atomi di carbonio all'interno delle molecole (per esempio, molecole dei primi tre composti di un numero di alcani: metano - 1 atomo di carbonio, etano - 2, propano - 3).
I nomi dei composti che contengono 1 atomo di carbonio iniziano con il prefisso "meth", 2 atomi - "et", 3 atomi - "prop". Tali composti, appartenenti alla prima serie omogenea, hanno proprietà chimiche simili, ma diversi tipi fisici. E quei composti che hanno pochi atomi di carbonio sono gas, un numero sufficientemente grande di atomi sono liquidi e i solidi sono eccessivamente sovrasaturati con gli atomi.
Il numero di composti organici è abbastanza grande a causa della capacità degli atomi di formare lunghe catene o anelli. Queste unità strutturali sono bloccate insieme a causa di legami covalenti (i loro elettroni dei gusci esterni sono "generalmente disponibili"). Le forme di carbonio sono semplici (ogni coppia atomica divide tra loro 1 coppia di elettroni), 2 ° o 3 ° legame covalente (due e, rispettivamente, tre coppie di elettroni partecipano).
Dopo la reazione di un composto sufficientemente saturo (organico) con un altro composto, i legami esistenti vengono spezzati e alcuni atomi vengono sostituiti da altri.
Leggi stechiometriche di base della chimica
Sono inclusi in questa sezione della chimica, come stechiometria. È noto che contiene le seguenti leggi di base della chimica:
- Gay-Lussac;
- Avogadro;
- equivalenti e conservazione di massa;
- più relazioni;
- consistenza della composizione.
L'essenza della legge di conservazione di massa ed energia
La base della formazione delle equazioni chimiche è il metodo dell'equilibrio materiale, la cui base è la legge di conservazione della massa (chimica). Secondo lui, la massa dei reagenti è identica alla massa dei prodotti finali della reazione.
Fu scoperto per la prima volta da MV Lomonosov nel 1748. Poi il chimico francese A. Lavoisier (1789) arrivò agli stessi risultati.
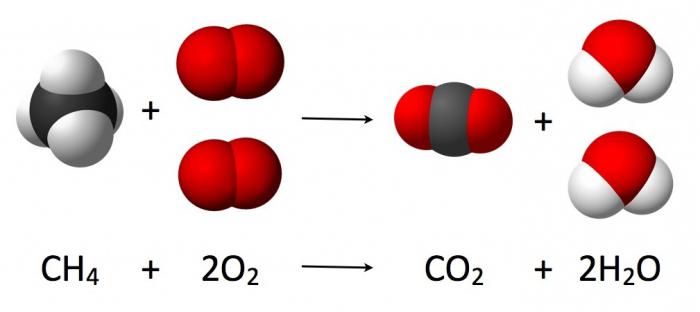
Nel corso di una reazione chimica, il numero di atomi interagenti è invariabile (si osserva solo il loro riarrangiamento, accompagnato dalla distruzione delle sostanze iniziali). L'interazione fluente dell'ossigeno con l'idrogeno, che porta alla formazione di acqua, può essere scritta dall'equazione della reazione chimica corrispondente (come nella figura sotto). 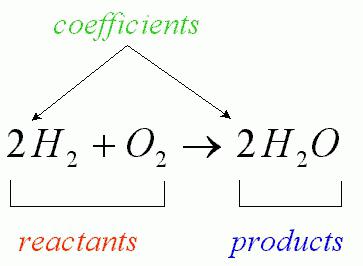
Le formule di questi composti chimici sono i coefficienti che sono chiamati "stechiometrici". La formula moderna è decifrata come segue: la somma delle masse e delle energie all'interno di un sistema isolato è costante.
Ha la forma: E = m · c², dove
c è la velocità della luce (3 · 10⁸ m / s);
All'inizio del 20 ° secolo, Albert Einstein riuscì a dimostrare la validità di questa equazione per qualsiasi forma di materia.
L'essenza della legge della costanza
Fu formulato dai chimici francesi J. Proust e C. L. Berthollet nel 1808. Si afferma che ogni singola sostanza ottenuta con qualsiasi metodo noto ha sempre una composizione quantitativa e qualitativa costante.
La legge della costanza della materia (chimica) ha reso possibile esprimere la composizione delle sostanze mediante segni chimici, gli indici corrispondenti (ad esempio, H₂O, C₂H₅OH, CH₄). All'inizio del XX secolo (1912-1913), l'eminente professore russo N. S. Kurnakov rivelò l'esistenza di composti di composizione variabile, che chiamò berthollides .
Se ricordi la prossima lezione di chimica, la legge della costanza della composizione è considerata giusta per le sostanze che hanno una struttura molecolare. Come già accennato in precedenza, oltre alle sostanze con una composizione costante, ci sono anche sostanze con variabili: l'alternanza di unità strutturali monolitiche (ioni, atomi) procede in violazione della periodicità stabilita.
A causa della presenza di composti con composizione variabile, la legge della costanza della composizione (chimica) contiene chiarimenti sul fatto che esiste una relazione diretta tra la struttura della composizione dei composti e i metodi per la loro preparazione: se esiste una struttura molecolare, la composizione non cambia in base a nessun metodo di preparazione, ma in una situazione in cui la struttura non è molecolare (reticolo ionico, atomico e metallico), la composizione dipende dalle condizioni specifiche di produzione. 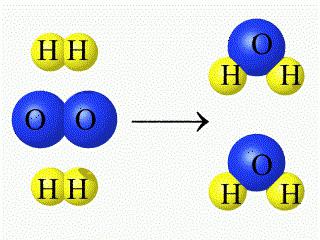
Legge sugli equivalenti
È stato scoperto dal chimico tedesco N. Richter ed è composto da quanto segue: le masse di sostanze che interagiscono (chimiche) sono uguali o sono multipli delle masse dei loro equivalenti chimici (grado chimico 11).
Equivalente è una particella condizionale o reale di sostanze in grado di sostituire, rilasciare, attaccare, ecc., Che è uguale al primo ione idrogeno delle reazioni di scambio ionico o acido-base; 1a reazione redox dell'elettrone.
In un modo diverso, si può dire che una mole di equivalenti (una certa quantità di una sostanza contenente tanti elementi strutturali quanti sono gli atomi di carbonio in 12 g dell'isotopo ¹²C) della 1a sostanza reagisce con la stessa mole di equivalenti, ma di una sostanza diversa .
Matematicamente, questa legge è:
mₐ: Mₔ (A) = mᵦ: Mₔ (B), dove
mₐ è la massa di una certa sostanza A,
mᵦ è la massa di una sostanza B,
Mₔ (A) è l'equivalente di massa (molare) della corrispondente sostanza A,
Mₔ (B) - massa (molare) equivalente della sostanza B.
Accade che una sostanza che reagisce inizialmente risieda nello stato solido e l'altra nello stato gassoso. Quindi la legge in esame è espressa dalla seguente formula:
mₐ: Mₔ (A) = Vb: Vₔ (B).
L'essenza della legge delle relazioni multiple
Fu formulato dal chimico inglese D. Dalton nel 1803. La sua essenza è che in una situazione in cui 2 elementi chimici creano diversi composti (molecolari), le frazioni di massa di ciascuno di essi sono correlate come numeri interi (grado di chimica 11).
Nel processo di interazione di ossigeno e azoto si ottengono 5 ossidi. Nelle molecole emergenti per 1 g di azoto viene calcolata la seguente quantità di ossigeno in grammi: 0,57, 1,14, 1,71, 2,28, 2,85. Correlano in proporzioni: 2: 1, 1: 1, 2: 3, 1: 2, 2: 5 (composizioni: NO, NO, N₂O₃, NO₂, N₂O₅).
Le leggi di Avogadro e le relazioni di volume
L'essenza di quest'ultima: in condizioni identiche, i volumi dei gas reagenti si correlano tra loro e i volumi dei prodotti gassosi risultanti come numeri interi (J. Gay-Lussac).
Nel caso dell'interazione di sostanze gassose, i loro volumi sono correlati come equazioni di reazione dei coefficienti (stechiometrici): 2H₂ + O₂ = 2H₂O (g).
Per quanto riguarda La legge di Avogadro, quindi la sua formulazione è la seguente: volumi di gas identici nelle stesse condizioni contengono lo stesso numero di moli.
Matematicamente, può essere rappresentato come segue:
n (x) = m: M (x), dove
n (x) è il numero richiesto di moli di una sostanza,
m è la massa della sostanza corrispondente
M (x) è la massa molare del reagente.
Conseguenze di questa legge:
- Una sostanza gassosa a 1 molare sostituisce un volume di 22,4 litri (in condizioni normali).
- Una sostanza gassosa da 1 mol contiene un numero identico di molecole, che è uguale a 6.023 1023 - il numero di Avogadro.
- Con masse note di sostanze gassose o loro masse molari, è possibile determinare la densità relativa: mₐ: mᵦ = pₐ: pᵦ, dove
pₐ, pᵦ - densità delle sostanze A e B, g / cm ³.
Quindi, le leggi di base della chimica (stoichiometrica) erano elencate sopra. Il prossimo sarà considerato gas e termodinamica.
Leggi di gas della chimica
Solo quattro leggi:
1. Boyle - Mariotta: se la temperatura è un valore costante (T = const) all'interno del processo isotermico, allora la pressione prodotta dalla massa di gas è inversamente proporzionale al suo volume: pV = const.
2. Gay-Lussac: se la pressione del gas è costante (p = const) all'interno processo isobarico allora il suo volume è direttamente proporzionale alla temperatura assoluta: V: T = const. 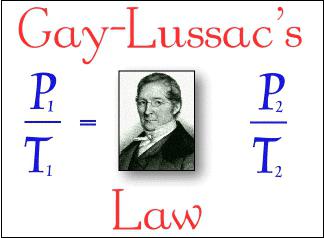
3. Charlie: se il volume del gas è un valore costante nel quadro del processo isocoro, la sua pressione è direttamente proporzionale alla temperatura assoluta: P: T = const.
4. Combined gas: pV: T = const.
Queste sono le leggi fondamentali della chimica del gas.
Le leggi della termodinamica chimica
Ce ne sono tre:
1. Legge sulla conservazione dell'energia (chimica): se nel corso di qualsiasi processo l'energia del primo tipo scompare, allora una diversa forma di energia "viene" per sostituirla e in una quantità diversa che è strettamente equivalente al 1 °. Pertanto, si può affermare che all'interno di qualsiasi sistema isolato, la riserva totale di energia rimane invariata.
2. Entro i confini di un sistema isolato, i processi che si verificano spontaneamente aumentano l'entropia (trasformazione) del sistema.
3. Se la temperatura tende a zero, l'entropia del sistema rimane invariata (indipendentemente dai suoi parametri).
Queste sono le leggi fondamentali della termodinamica (chimica).
L'essenza della legge delle masse
Questa è la legge fondamentale della chimica fisica. La legge di azione delle masse (in chimica): la velocità con cui procede una reazione chimica è proporzionale al prodotto delle concentrazioni di reagenti.
Nel caso di una reazione omogenea con il 1 ° stadio (A + B - prodotti di reazione), questa legge può essere rappresentata come un'equazione:
v = k · cₐ · cᵦ, dove
v è la velocità di reazione
cₐ, cᵦ - concentrazioni di reagenti, rispettivamente, A e B, mol / l,
k è la costante della velocità di reazione.
La legge di azione delle masse (in chimica) permette di identificare il significato fisico di questa costante: è uguale alla velocità di reazione alle concentrazioni dei reagenti a 1 mol / lo al valore del loro prodotto uguale a uno. La costante dipende dalla temperatura, dalla natura dei reagenti, ma non dalle loro concentrazioni.
Legge periodica: formulazione, ruolo
Si riconosce che questa legge è il risultato più importante in chimica, si potrebbe dire, la base della chimica moderna. Dopo la sua scoperta, cessò di essere una scienza esclusivamente descrittiva, la cosiddetta previsione scientifica divenne possibile.
La legge periodica (chimica) fu scoperta dal famoso scienziato russo Dmitri Ivanovich Mendeleev nel 1869. La formulazione ufficiale: "Le proprietà dei corpi semplici, così come le forme e le proprietà dei composti degli elementi sono in dipendenza periodica dalle dimensioni dei pesi atomici degli elementi".
Queste sono le leggi fondamentali della chimica (fisica).
Chimica come sistema di conoscenza delle sostanze e delle loro trasformazioni
La conoscenza viene ricavata da informazioni esaustive affidabili su composti ed elementi (chimici), le loro reazioni, comportamento nel quadro dell'ambiente naturale e artificiale. I criteri esistenti per l'affidabilità dei fatti studiati, così come i modi per organizzarli sono in continua evoluzione. Principali generalizzazioni vengono trasferite a leggi scientifiche, la cui formulazione consente di aprire nuove fasi della chimica (ad esempio, le leggi fondamentali della chimica: legge di Dalton, legge periodica di Mendeleev, ecc.). Gli aspetti teorici, in cui sono applicati concetti specifici, consentono di spiegare e prevedere i fatti di un dominio soggetto più ristretto. Pertanto, si può affermare che la conoscenza, supportata dall'esperienza, diventa un fatto solo dopo la sua interpretazione teorica.
Quindi, la prima teoria chimica è la teoria del "flogisto" (è riconosciuta come errata), promuoveva la formazione della chimica moderna, in considerazione del fatto che combinava i fatti sparsi in un unico sistema, permettendogli di formulare una serie di nuove domande. Ma la teoria strutturale (F. Kekule, A. M. Butlerov) ha contribuito a semplificare e spiegare l'ampio materiale della chimica organica e determinare lo sviluppo accelerato della sintesi chimica, oltre a studiare la struttura dei composti organici.
La scienza in questione come conoscenza è un sistema molto dinamico. La natura evolutiva del processo di accumulazione della conoscenza viene periodicamente interrotta dalle rivoluzioni: una radicale ristrutturazione del sistema di teorie, metodi e fatti con l'avvento di una nuova serie di concetti o anche di uno stile radicalmente nuovo di visione e pensiero del mondo. Così, le opere di Antoine Laurent Lavoisier (l'introduzione di metodi quantitativi di esperimento, la teoria materialistica dell'ossidazione, lo sviluppo della nomenclatura chimica), la legge periodica di Mendeleev, lo sviluppo di nuovi metodi analitici (cromatografia, microanalisi), l'emergere di nuove aree che formano il nuovo soggetto della chimica e che influenzano tutti i suoi campi (ad esempio, chimica fisica, basato sulla base della cinetica chimica e della termodinamica).
Vale anche la pena notare che la conoscenza chimica è dotata di una struttura sviluppata, la cui struttura chimica è le principali discipline chimiche formate nel 19 ° secolo (chimica organica, analitica, inorganica e fisica). Successivamente, nel processo della sua evoluzione, apparvero molte nuove discipline (chimica bio- e cristallina, ecc.) E ingegneria - la tecnologia chimica.
Quindi, l'articolo ha esaminato i concetti di base e le leggi della chimica.