Sodio acetato (proprietà e usi)
Questa sostanza chimica è comunemente nota con il nome di famiglia "hot ice". Infatti, l'acetato di sodio (C 2 H 3 O 2 Na) è cristalli artificiali di quei sali che fanno parte dell'acido acetico. Questa sostanza è ampiamente distribuita in natura. Fa parte di molti cellule vegetali e origine animale, quindi l'acetato di sodio può essere trovato in molti frutti e bacche. Inoltre, la sua formazione si verifica durante la fermentazione batterica, che porta al suo aspetto nei prodotti a base di latte fermentato.
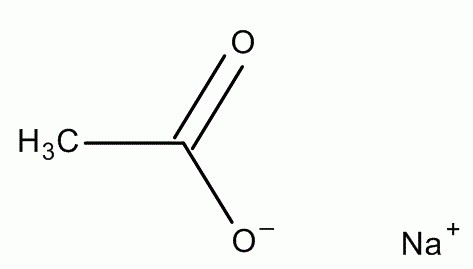
Proprietà chimiche
Non senza ragione, l'acetato di sodio è stato chiamato "ghiaccio caldo", perché è molto caldo nel processo di cristallizzazione esotermica. Questa sostanza ha una struttura cristallina. È quasi incolore e ha un lieve odore di acido acetico. I suoi cristalli hanno una caratteristica distintiva: si dissolvono molto male in etere e alcol, ma durante l'interazione con l'acqua, si trasformano molto rapidamente in soluzione di acetato di sodio. Pertanto, 76 g di questa sostanza vengono sciolti in 100 ml di H 2 O. L'acetato di sodio ha un basso livello di tossicità e non è infiammabile. Il calore specifico della sua fusione è 264-289 k, e la temperatura di decomposizione: 324 ° C. L'acetato di sodio, il cui triidrato ha un punto di fusione di 58 ° C, quando riscaldato a 100 ° C in un contenitore situato in acqua bollente, si dissolve nella sua acqua di cristallizzazione (sciolta). Pertanto, viene convertito in una soluzione. Quando si raffredda, c'è un'eccessiva presenza di questa sostanza nell'acqua. Tale soluzione è notevolmente superraffreddata ad una temperatura di 20-24 ° C senza la formazione della sua fase solida. Dopo aver cliccato sul metallo nella nave, si forma un centro di cristallizzazione. Nel processo di crescita, questa soluzione viene trasformata nella fase solida di sodio acetato triidrato. Questo processo accompagna una produzione di calore significativa (264-289 kJ / kg).
Ad
Modi per ottenere acetato di sodio
 Questa sostanza può essere ottenuta, sia in ambito industriale e di laboratorio, sia a casa. In grandi quantità, l'acetato di sodio viene prodotto per distillazione a secco di alcuni tipi di legno. Nei laboratori, questa sostanza è ottenuta nel processo dell'interazione dell'acido acetico con i composti del sodio come carbonato, idrocarbonato, idrossido.
Questa sostanza può essere ottenuta, sia in ambito industriale e di laboratorio, sia a casa. In grandi quantità, l'acetato di sodio viene prodotto per distillazione a secco di alcuni tipi di legno. Nei laboratori, questa sostanza è ottenuta nel processo dell'interazione dell'acido acetico con i composti del sodio come carbonato, idrocarbonato, idrossido.
Come rendere l'acetato di sodio a casa
 Anche una persona lontana dalla profonda conoscenza nel campo della chimica può ottenere questa sostanza da sola. Per questo hai bisogno solo di due elementi: bicarbonato di sodio e acido acetico. L'equazione di una reazione chimica quando si combinano questi prodotti ha la seguente forma:
Anche una persona lontana dalla profonda conoscenza nel campo della chimica può ottenere questa sostanza da sola. Per questo hai bisogno solo di due elementi: bicarbonato di sodio e acido acetico. L'equazione di una reazione chimica quando si combinano questi prodotti ha la seguente forma:
- NaHCO 3 + CH 3 COOH = CH 3 COONa + H 2 CO 3 .
In altre parole, ottenere l'acetato a casa si chiama "soda soda". Come risultato di questa reazione chimica, si ottiene un composto instabile che si decompone all'istante in acqua e anidride carbonica. Durante l'evaporazione della soluzione risultante, si forma un acetato di sodio cristallino. Come regola generale, per ottenerlo, la soda e l'acido vengono presi in rapporti: 84 g di bicarbonato di sodio con 750 g di aceto (8%) o 86 g di essenza acetica (70%). In quest'ultimo caso, l'evaporazione non è richiesta. Come conseguenza della reazione, si ottengono circa 80 g di sodio acetato.
Altri nomi sodio acetato
Molto spesso, i seguenti sinonimi sono usati per denotare questa sostanza: sale di sodio di acido acetico, acetato di sodio, etanoato di sodio.

Uso di acetato di sodio come additivo alimentare
Questa sostanza è utilizzata in vari settori. Quindi, nell'industria alimentare è usato come conservante sotto la denominazione E262. Oggi, la produzione di determinati prodotti alimentari non è senza di essa. Così, l'acetato di sodio viene aggiunto alla farina per proteggere i prodotti da forno dalla cosiddetta "malattia della patata" causata dal batterio Bacillus mesentericus, che è molto diffuso in natura. Con la produzione di trucioli si usa anche questo additivo per dare loro gusto e aroma piacevoli. E262 è anche aggiunto alle verdure in scatola, poiché il suo effetto sui prodotti ammorbidisce il gusto molto acuto dell'acido acetico. Molte persone sono molto diffidenti nei confronti di vari tipi di additivi alimentari. In effetti, E262 a causa della sua bassa tossicità è approvato per l'uso in tutti i paesi europei. Anche la Federazione Russa non ha stabilito la dose giornaliera massima di acetato di sodio.
Ad
Usare in medicina
Non è raro usare questa sostanza per scopi medici. È disponibile come parte di molti farmaci. Quindi, in particolare, può essere trovato in molti preparati diuretici. Gli acetati di sodio sono usati come agenti alcalinizzanti nell'acidosi e nell'iponatriemia metabolica.
Uso della sostanza in altri settori

Oltre alle suddette applicazioni, l'acetato di sodio viene utilizzato nell'industria tessile e nell'edilizia. Questa sostanza è usata per neutralizzare il già speso acido solforico entrare nei liquami. L'acetato di sodio viene utilizzato come fotoresist nella lavorazione dei tessuti coloranti all'anilina. Viene anche utilizzato nel processo di concia delle pelli con sali di cromo (acquaforte). L'acetato di sodio durante la produzione di gomma sintetica rallenta la polimerizzazione del cloroprene. Viene utilizzato come additivo antigelo per qualsiasi tipo di calcestruzzo nella produzione di strutture monolitiche. Questa sostanza è utilizzata nella produzione di riscaldatori e riscaldatori cosiddetti "chimici". Ciò è dovuto alla sua capacità di riscaldare a temperature piuttosto elevate. L'acetato di sodio è il componente principale di una miscela diffusa chiamata "ghiaccio caldo". Questa sostanza viene anche utilizzata nella produzione di anidride acetica, saponi, acetil cloruro, acetati di rame, acetato di vinile e altri prodotti chimici. È usato come catalizzatore di policondensazione e componente di fissativi acidi per fotografie. Viene utilizzato per produrre elettroliti e soluzioni tampone nella galvanoplastica.
Ad

Proprietà negative della sostanza
Sebbene l'acetato di sodio e la bassa tossicità, il suo uso eccessivo possono ancora causare danni significativi alla salute umana. Quindi, non è raccomandato per le persone affette da tali malattie: ipertensione arteriosa, distonia vegetativa-vascolare, disbatteriosi. Dovrebbe limitare significativamente il consumo di prodotti contenenti E262 e quelli che hanno problemi con intestino, tratto urinario, fegato, cistifellea. Ciò è dovuto al fatto che l'acetato di sodio nell'intestino è spesso convertito in nitrati tossici, che sono cancerogeni. Ecco perché i medici avvertono che il consumo eccessivo di prodotti contenenti E262 può portare alla formazione di tumori maligni, avvelenamento e reazioni allergiche. L'acetato di sodio non può essere utilizzato nella produzione di prodotti alimentari per bambini, quindi la presenza sulla confezione della marcatura E262 è un motivo serio per non acquistarli.
Ad
Segni di avvelenamento acetato di sodio
Questi includono: vertigini, mal di testa, pelle pallida, dolore acuto nell'addome, incoordinazione, difficoltà di respirazione, crampi, svenimenti.
L'interazione di sodio acetato con altre sostanze
La combinazione di questa sostanza chimica con acido formico dà addotti. Come risultato della sua combinazione con l'ossido di azoto, si formano nitrito di sodio e anidrite acetica. Sostanze come l'acetato di sodio + l'acido solforico concentrato forniscono acido acetico nel composto.