La teoria della dissociazione elettrolitica - una delle principali in chimica
Quando si dissolvono in acqua, le sostanze elettrolitiche si decompongono in particelle cariche - ioni. L'opposto è molarizzazione, o associazione. La formazione di ioni spiega la teoria della dissociazione elettrolitica (Arrhenius, 1887). Il meccanismo di decomposizione dei composti chimici durante la fusione e la dissoluzione è influenzato dalle caratteristiche dei tipi di legami chimici, dalla struttura e dalla natura del solvente.
Elettroliti e non conduttori
La distruzione avviene in soluzioni e si scioglie reticoli cristallini e molecole - dissociazione elettrolitica (ED). La decomposizione delle sostanze è accompagnata dalla formazione di ioni, l'aspetto di proprietà come la conduttività elettrica. Non tutti i composti sono in grado di dissociarsi, ma solo le sostanze che inizialmente sono costituite da ioni o particelle altamente polari. La presenza di ioni liberi spiega la proprietà degli elettroliti di condurre corrente. Base, sale, molti inorganici e alcuni acidi organici possiedono questa capacità. I non conduttori sono costituiti da molecole a bassa polarità o non polarizzate. Non si scompongono in ioni, essendo non elettroliti (molti composti organici). I portatori di carica sono ioni positivi e negativi (cationi e anioni).
Ad
Il ruolo di S. Arrhenius e di altri chimici nello studio della dissociazione
La teoria della dissociazione elettrolitica fu dimostrata nel 1887 da uno scienziato svedese S. Arrhenius. Ma i primi studi approfonditi sulle proprietà delle soluzioni furono condotti dallo scienziato russo M. Lomonosov. Contribuito allo studio di particelle cariche derivanti dalla dissoluzione di sostanze, T. Grotgus e M. Faraday, R. Lenz. Arrhenius ha dimostrato che molti elettroliti inorganici e alcuni composti organici. Uno scienziato svedese ha spiegato la conduttività elettrica delle soluzioni con il decadimento di una sostanza in ioni. La teoria della dissociazione elettrolitica di Arrhenius non attribuiva importanza alla partecipazione diretta delle molecole d'acqua in questo processo. Gli scienziati russi Mendeleev, Kablukov, Konovalov e altri ritenevano che la solvatazione stesse avvenendo - l'interazione di un solvente e di un soluto. Quando si parla di sistemi idrici, viene utilizzato il nome "idratazione". Questo è un complesso processo fisico-chimico, come evidenziato dalla formazione di idrati, fenomeni termici, scolorimento della materia e la comparsa di sedimenti.
Ad

Le principali disposizioni della teoria della dissociazione elettrolitica (TED)
Molti scienziati hanno lavorato per chiarire la teoria di S. Arrhenius. È stato necessario migliorarlo, tenendo conto dei dati moderni sulla struttura dell'atomo, legame chimico. Le principali disposizioni del TED sono formulate, che differiscono dalle tesi classiche della fine del XIX secolo:
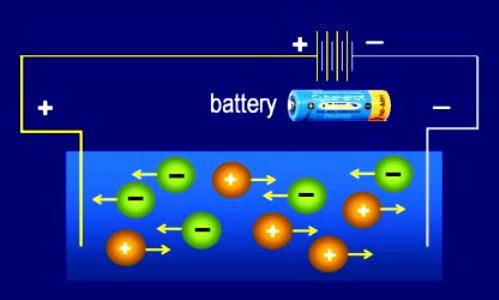
- Il processo di fusione o dissoluzione è accompagnato dalla dissociazione dell'elettrolita in ioni. Quindi (su suggerimento di Faraday) chiamate particelle con una carica ("+" o "-"). Si differenziano dagli atomi neutri nella struttura dei gusci di valenza e stabilità, sono colorati e incolori. Gli ioni possono essere semplici: Na + , Cl - , S 2- , Al 3+ . Ci sono particelle cariche costituite da gruppi di atomi: CO 2 , NH 4+ . Dal greco, il nome "ione" è tradotto come "errante", che indica la casualità della propagazione di queste particelle.
- L'impatto di un campo elettrico esterno fa sì che gli ioni si muovano in modo ordinato all'interno dello spazio dell'elettrolita. Ogni particella negativa è diretta verso l'anodo (elettrodo positivo). Gli ioni con segno "+" iniziano a muoversi verso il catodo (elettrodo negativo).
- Allo stesso tempo, la decomposizione in ioni e la combinazione di queste particelle si verificano nelle soluzioni, quindi la dissociazione si riferisce a processi fisico-chimici reversibili.
I fenomeni che si verificano devono essere presi in considerazione quando si compongono le equazioni: applicare il segno speciale del processo reversibile, calcolare gli addebiti negativi e positivi: devono coincidere in somma.
Il meccanismo delle sostanze ioniche ED
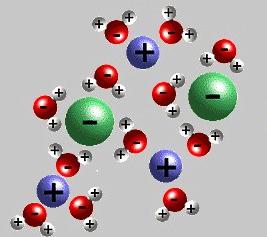
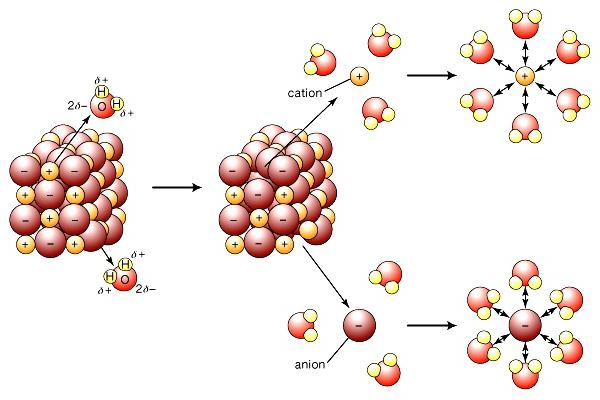
La moderna teoria della dissociazione elettrolitica tiene conto della struttura delle sostanze elettrolitiche e dei solventi. Quando si dissolvono, i legami tra particelle cariche opposte nei cristalli ionici vengono distrutti dall'azione delle molecole di acqua polare. Letteralmente "tirano" gli ioni dalla massa nella soluzione. Il decadimento è accompagnato dalla formazione di un guscio di solvatazione (in acqua - idratazione) attorno agli ioni. Oltre all'acqua, i chetoni, gli alcoli inferiori, hanno una costante dielettrica più alta. Durante la dissociazione cloruro di sodio Gli ioni Na + e Cl -1 registrano uno stadio iniziale, che è accompagnato dall'orientamento dei dipoli d'acqua rispetto agli ioni superficiali nel cristallo. Nella fase finale, gli ioni idratati vengono rilasciati e diffusi nel liquido.
Ad
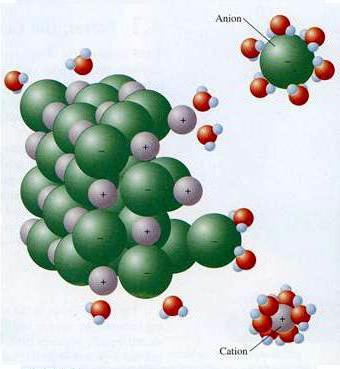
Il meccanismo dei composti ED con un legame covalente fortemente polare
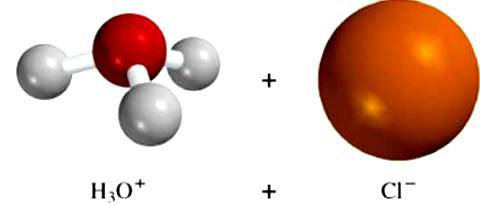
Le molecole solventi influenzano la struttura cristallina delle sostanze non ioniche. Ad esempio, l'effetto dei dipoli di acqua sull'acido cloridrico porta a un cambiamento nel tipo di legame nella molecola polare covalente a quella ionica. La sostanza si dissocia, idrogeno idrato e ioni di cloro entrano nella soluzione. Questo esempio dimostra l'importanza dei processi che si verificano tra le particelle di solvente e il composto disciolto. È questa interazione che porta alla formazione di ioni elettrolitici.
Teoria della dissociazione elettrolitica e delle principali classi di composti inorganici
Alla luce delle principali disposizioni TED, un acido può essere chiamato un elettrolita, durante il decadimento di quale degli ioni positivi può essere rilevato solo il protone H + . La dissociazione della base è accompagnata dalla formazione o rilascio dal reticolo cristallino del solo anione OH e del catione metallico. Un sale normale quando sciolto dà uno ione metallico positivo e uno negativo - il residuo di un acido. Il sale principale è caratterizzato dalla presenza di due tipi di anioni: il gruppo OH e il residuo acido. Nel sale acido dei cationi sono presenti solo idrogeno e metallo.
Ad
Resistenza agli elettroliti
Per caratterizzare lo stato di una sostanza in una soluzione, viene utilizzata una quantità fisica - il grado di dissociazione (α). Trova il suo valore dal rapporto tra il numero di molecole spezzate e il loro numero totale in soluzione. La profondità della dissociazione è determinata da condizioni diverse. Importanti indicatori dielettrici del solvente, la struttura dei composti disciolti. Tipicamente, il grado di dissociazione diminuisce all'aumentare della concentrazione e aumenta all'aumentare della temperatura. Spesso, il grado di dissociazione di una particolare sostanza è espresso in frazioni di un'unità.
Classificazione degli elettroliti
La teoria della dissociazione elettrolitica alla fine del XIX secolo non conteneva una disposizione sull'interazione degli ioni in soluzione. L'effetto delle molecole d'acqua sulla distribuzione di cationi e anioni sembrava essere insignificante per Arrhenius. Le idee di Arrhenius sugli elettroliti forti e deboli erano formali. Sulla base delle posizioni classiche, si può ottenere α = 0,75-0,95 per elettroliti forti. Gli esperimenti hanno dimostrato l'irreversibilità della loro dissociazione (α → 1). Sali solubili, solforico e acido cloridrico alcali. Dissociare parzialmente il solfuro, l'azoto, l'idrofluorico, acido fosforico. Gli elettroliti deboli sono acidi silici, acetici, idrosolfurici e carbonici, idrossido di ammonio, basi insolubili. L'acqua è anche indicata come elettroliti deboli. Una piccola parte delle molecole di H 2 O si dissocia e gli ioni sono simultaneamente molati.