Modello atomico di Thomson: descrizione e confutazione
Modello atomico Thomson - uno dei primi modelli la struttura dell'atomo successivamente insolvenza riconosciuta. Prima proposta da DD. Thomson nel 1904, poco dopo la scoperta degli elettroni, ma prima della scoperta del nucleo atomico.
preistoria
Nel 1897, un evento significativo si verificò in fisica: Thompson Joseph John scoprì elettroni, confermando così in modo sperimentale l'ipotesi che l'atomo non fosse una particella "monolitica". Tuttavia, non c'era un'idea esatta di cosa fossero le particelle elementari. Solo nel 1911 verrà presentato un modello più accurato dell'atomo di Rutherford, e prima ancora il mondo scientifico lottava freneticamente con il "mistero del secolo".

Cerca risposta
Dopo una serie di esperimenti, si è scoperto che gli elettroni hanno carica negativa e nel frattempo era già noto che gli atomi hanno una carica neutra. Thomson ha ragionevolmente suggerito che l'atomo dovrebbe avere una certa fonte di carica positiva per compensare il negativo carica di elettroni.
Ad
Il fisico inglese ha presentato tre possibili meccanismi di interazione all'interno delle particelle.
- Nel primo modello dell'atomo di Thomson, ciascun elettrone caricato negativamente si attaccava alla particella caricata positivamente che la seguiva ovunque all'interno dell'atomo.
- Nel secondo modello, gli elettroni ruotano attorno alla regione centrale di una carica positiva, che ha la stessa grandezza di tutti gli elettroni.
- Nel terzo modello, gli elettroni occupavano una regione dello spazio, che a sua volta era una carica positiva uniforme (spesso chiamata "zuppa" o "nuvola" di carica positiva).
Lo scienziato ha scelto la terza opzione: la struttura più probabile degli atomi.

Attenzione pubblica
Il modello atomico Thomson del 1904 fu pubblicato nel numero di marzo di Philosophical Magazine, l'autorevole rivista scientifica britannica. Secondo l'autore, gli atomi degli elementi consistono in una serie di corpuscoli elettrizzati negativamente (elettroni), racchiusi in una sfera di elettrificazione uniforme uniforme. Thomson abbandonò la sua precedente ipotesi di un "atomo nebbioso", in cui le particelle erano costituite da vortici intangibili.
Ad
La pubblicazione ha causato un genuino interesse per la comunità scientifica. Tuttavia, non aveva prove concrete e, pertanto, fu criticata da molti fisici autorevoli. Tuttavia, corrispondeva alle idee e ai dati sperimentali che erano noti in quel momento.
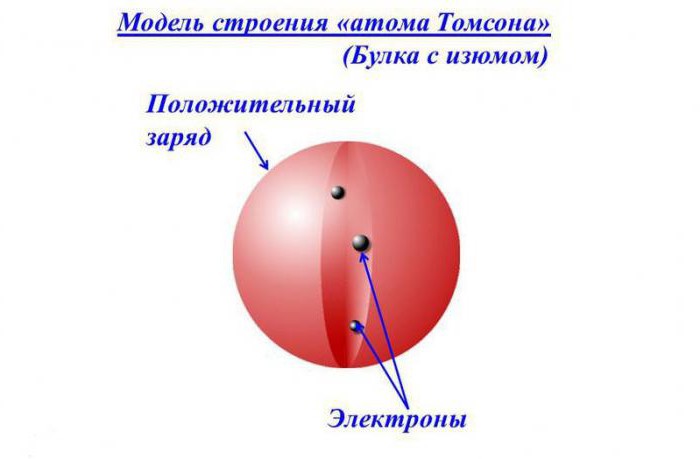
Descrizione del modello
Uno scienziato astuto e pratico, Thomson ha basato il suo modello atomico su dati sperimentali noti. La proposta di un importo positivo riflette la natura del suo approccio scientifico alla scoperta, che è diventata una guida all'azione per esperimenti futuri.
Secondo la teoria, le orbite degli elettroni all'interno del modello atomico di Thomson erano stabilizzate dal fatto che quando l'elettrone si allontanava dal centro della sfera carica positivamente (nuvola), era esposto ad aumentare forze di attrazione. Questa forza restituisce l'elettrone indietro, perché secondo la legge di Gauss, c'è una maggiore concentrazione di carica positiva all'interno della sfera. Secondo il modello, gli elettroni potevano liberamente ruotare in anelli, che erano inoltre stabilizzati dall'interazione tra gli elettroni, ei valori spettroscopici spiegavano le differenze di energia tra le singole orbite dell'anello.
Ad
Secondo l'idea di quel tempo, gli elettroni erano situati in una sfera carica positivamente come uvetta in una torta, o pezzi di frutta in un dolce preferito britannico - budino di prugne. Pertanto, il concetto è anche chiamato il modello di "pudding" dell'atomo.
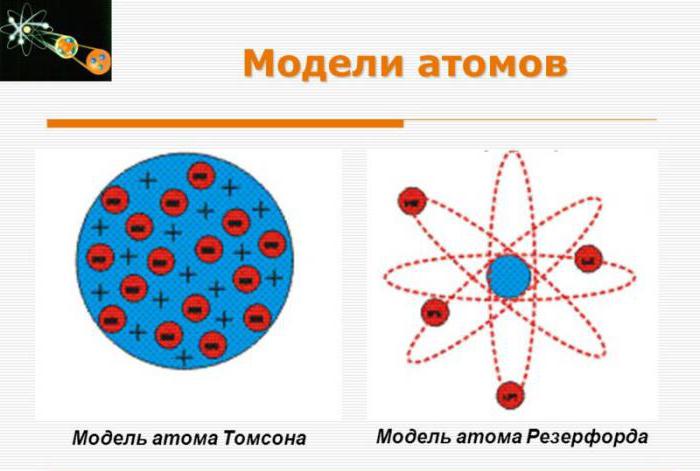
Dilemma di incoerenza
Con l'accumulo di dati sperimentali, è stata osservata una incoerenza di questa teoria sempre più chiaramente. Thomson ha tentato invano di rifare il suo modello per spiegare alcune delle principali linee spettrali identificate sperimentalmente per diversi elementi.
Nel 1909, Hans Geiger ed Ernest Marsden sotto la supervisione di un professore Ernest Rutherford condusse esperimenti con un sottile foglio d'oro, spargendo particelle alfa sulla lamina d'oro. I dati erano diversi da quelli previsti. Nel 1911, Rutherford, dopo molte discussioni, pubblicò il suo concetto, in seguito chiamato modello atomico di Rutherford. Assunse la presenza di un nucleo molto piccolo con una carica positiva più forte al centro degli atomi d'oro, sufficiente a contenere circa cento elettroni.
Ulteriore sviluppo
Subito dopo che Rutherford ha pubblicato i suoi risultati, Antonius Van den Broek ha suggerito intuitivamente che il numero atomico di un elemento è il numero totale di unità di carica presenti nel suo nucleo. Henry Mosley nel 1913 fornì i dati necessari per dimostrare la proposta di Van den Bruck. Si è constatato che la carica nucleare effettiva corrisponde al numero atomico.
Ad
Questo lavoro servì come base per Niels Bohr per creare un modello semiclassico di atomi nel 1913. Assomiglia all'interazione di luminari e pianeti nel sistema solare, ma solo con limiti quantici.

Valore per la scienza
Il modello atomico di Thomson fu l'impulso per il rapido sviluppo della fisica nucleare. Il concetto di "plum pudding" con un elettrone fu usato dal fisico Arthur Erich Haas nel 1910 per stimare il valore numerico della costante di Planck e il raggio di Bohr degli atomi di idrogeno. Il lavoro di Haas è stato pubblicato tre anni prima delle conclusioni di Niels Bohr. Va notato che il modello di Bohr fornisce previsioni abbastanza accurate per sistemi atomici e ionici con un elettrone efficace.
Inoltre, la teoria del "pudding" consente di determinare la distribuzione ottimale di cariche di punti uguali sulla sfera unitaria, chiamata Thomson Problem. A proposito, il sistema fisico incarnato nel problema Thomson è un caso speciale di uno dei diciotto problemi matematici irrisolti proposti dal matematico Steve Smale - "Distribuzione di punti su una sfera bidimensionale".
Il problema di Thomson è una conseguenza naturale del modello "beam pudding" in assenza di una carica di sfondo positiva uniforme. Anche l'interazione elettrostatica degli elettroni delimitata da punti quantici sferici è analoga alla loro elaborazione nel modello atomico di Thomson. In questo problema classico, un punto quantico viene modellato come una semplice sfera dielettrica (invece di una sfera omogenea caricata positivamente, come nel modello di "beam pudding"), in cui ci sono elettroni liberi o in eccesso.