Qual è una reazione reversibile?
Qual è una reazione reversibile? Questo è un processo chimico che avviene in due direzioni opposte. Considerare le principali caratteristiche di tali trasformazioni, nonché i loro parametri distintivi.
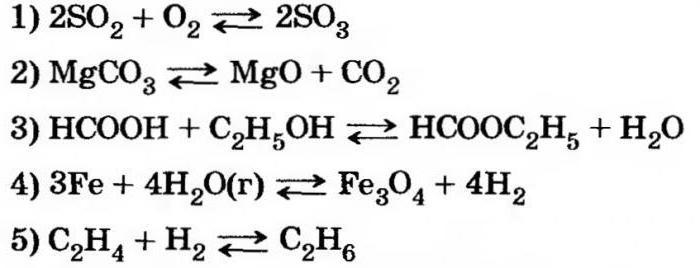
Qual è l'essenza dell'equilibrio
Le reazioni chimiche reversibili non producono determinati prodotti. Ad esempio, durante l'ossidazione dell'ossido di zolfo (4), contemporaneamente alla produzione di ossido di zolfo (6), i componenti iniziali vengono nuovamente formati.
I processi irreversibili comportano la completa trasformazione delle sostanze interagenti, accompagnate da una reazione simile che riceve uno o più prodotti di reazione.
Esempi di interazioni irreversibili sono reazioni di decomposizione. Ad esempio, durante il riscaldamento permanganato di potassio viene formato metallo manganato, ossido di manganese (4) e viene rilasciato ossigeno gassoso.
Ad
La reazione reversibile non implica la formazione di precipitazione, l'evoluzione del gas. Questa è precisamente la sua principale differenza dall'interazione irreversibile.
Equilibrio chimico è un tale stato del sistema interagente, in cui una o più reazioni chimiche possono verificarsi in modo reversibile a condizione che le velocità dei processi siano uguali.
Se il sistema è in equilibrio dinamico, non vi è alcun cambiamento di temperatura, concentrazione di reagenti, altri parametri in un determinato periodo di tempo.

Condizioni di spostamento dell'equilibrio
L'equilibrio di reazione reversibile può essere spiegato usando la regola di Le Chatelier. La sua essenza sta nel fatto che quando un impatto esterno viene esercitato su un sistema che è inizialmente in equilibrio dinamico, c'è una variazione nella reazione nella direzione opposta all'effetto. Qualsiasi reazione reversibile che usi questo principio può essere spostata nella giusta direzione in caso di cambiamenti di temperatura, pressione e concentrazione di sostanze interagenti.
Ad
Il principio di Le Chatelier "funziona" solo per i reagenti gassosi, le sostanze solide e liquide non vengono prese in considerazione. Esiste una relazione reciproca tra pressione e volume, definita dall'equazione di Mendeleev - Clapeyron. Se il volume dei componenti gassosi iniziali è maggiore dei prodotti di reazione, quindi per modificare l'equilibrio a destra, è importante aumentare la pressione della miscela.
Ad esempio, quando si trasforma monossido di carbonio (2) in anidride carbonica 2 mol reagisce monossido di carbonio e 1 mole di ossigeno. Questo forma 2 moli di monossido di carbonio (4).
Se dalla condizione del problema questa reazione reversibile deve essere spostata a destra, è necessario aumentare la pressione.
Anche la concentrazione dei reagenti ha un effetto significativo sul processo. Secondo il principio di Le Chatelier, in caso di aumento della concentrazione delle componenti iniziali, l'equilibrio del processo si sposta verso il prodotto della loro interazione.
In questo caso, una diminuzione (rimozione dalla miscela di reazione) del prodotto risultante contribuisce al flusso del processo diretto.
Oltre alla pressione, la concentrazione, un cambiamento di temperatura ha un effetto significativo sul corso del contrario o della reazione diretta. Quando la miscela iniziale viene riscaldata, si osserva uno spostamento di equilibrio verso il processo endotermico.
Ad

Esempi di reazioni reversibili
Considerare un processo specifico per spostare l'equilibrio verso la formazione di prodotti di reazione.
2CO + O 2 -2CO 2
Questa reazione è un processo omogeneo, poiché tutte le sostanze sono nello stesso stato (gassoso).
Nella parte sinistra dell'equazione ci sono 3 volumi di componenti, dopo l'interazione questo indicatore è diminuito, si formano 2 volumi. Per il flusso di un processo diretto, è necessario aumentare la pressione della miscela di reazione.
Considerando che la reazione è esotermica, la temperatura viene abbassata per produrre anidride carbonica.
L'equilibrio del processo si sposterà verso la formazione del prodotto di reazione con crescente concentrazione di uno dei materiali di partenza: ossigeno o monossido di carbonio.
conclusione
Le reazioni reversibili e irreversibili svolgono un ruolo importante nella vita umana. I processi di scambio che avvengono nel nostro corpo sono associati a un cambiamento sistematico nell'equilibrio chimico. Nella produzione chimica, vengono utilizzate condizioni ottimali per dirigere la reazione nella giusta direzione.