Cos'è il bromo? Elemento chimico bromo: formula, proprietà
Liquido di colore rosso-marrone, con un odore forte e specifico, scarsamente solubile in acqua, ma solubile in benzene, cloroformio, disolfuro di carbonio e altri solventi organici. Questa risposta può essere data alla domanda: "Cos'è il bromo?" Il composto appartiene al gruppo dei non-metalli più attivi, reagendo con molte sostanze semplici. È altamente tossico: l'inalazione del suo vapore irrita le vie respiratorie e il contatto con la pelle provoca gravi ustioni non cicatrizzanti. Nel nostro articolo studieremo le sue proprietà fisiche e considereremo anche reazioni chimiche caratteristica del bromo.

Cos'è il bromo?
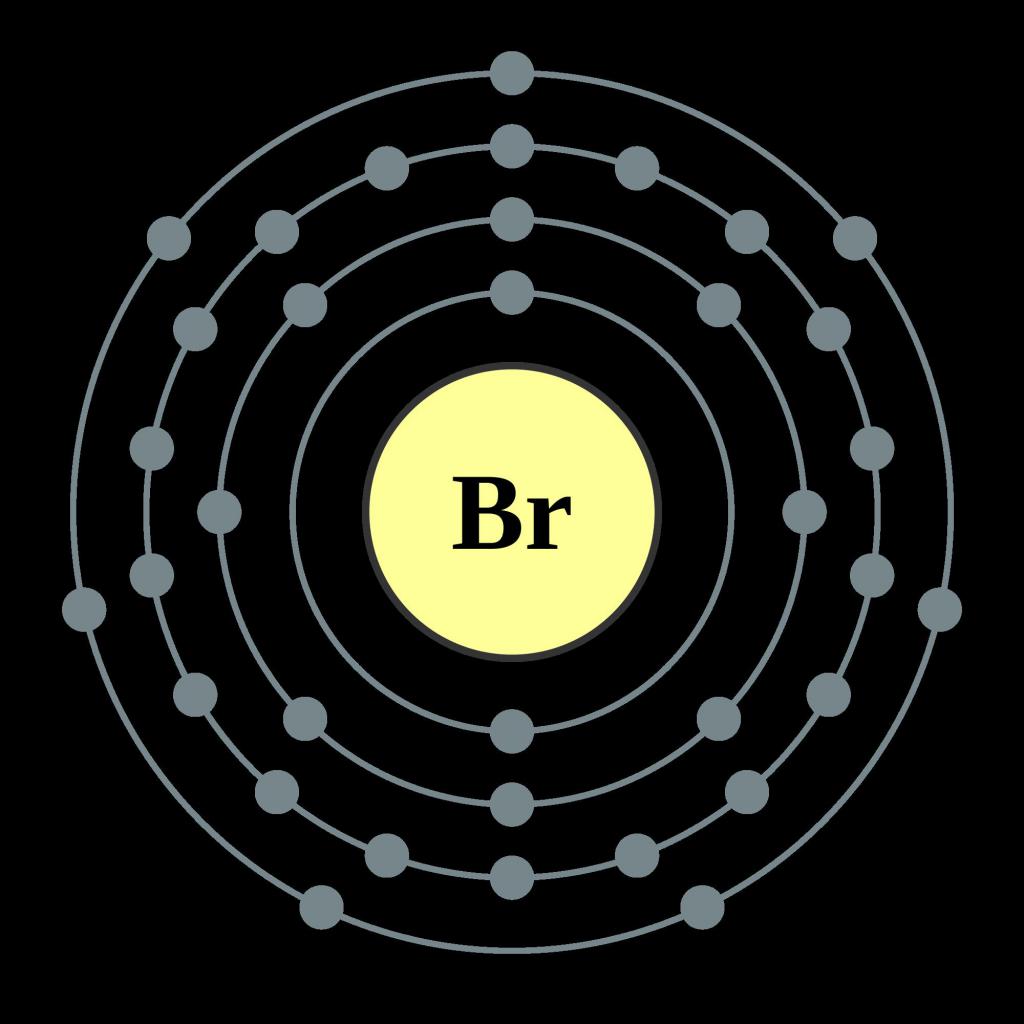
Il sottogruppo principale del settimo gruppo è la posizione dell'elemento nella tavola periodica degli elementi chimici. Sull'ultimo strato di energia di un atomo ci sono due elettroni s e cinque elettroni p. Come tutti gli alogeni, il bromo ha un'affinità significativa per l'elettrone. Ciò significa che attira facilmente particelle negative di altri elementi chimici nel suo guscio di elettrone, diventando un anione. Formula molecolare di bromo - Br 2 . Gli atomi sono interconnessi da una coppia di elettroni, questo tipo di legame è chiamato covalente. È anche non polare, essendo situato alla stessa distanza dai nuclei atomici. A causa del raggio atomico piuttosto grande - 1,14 °, le proprietà ossidanti dell'elemento, le sue proprietà di elettronegatività e non-metallo diventano inferiori a quelle del fluoro e del cloro. Il punto di ebollizione, al contrario, aumenta e ammonta a 59,2 ° C, la massa molecolare relativa del bromo è 180. Nello stato libero, a causa dell'alta attività, l'elemento non si trova come una sostanza semplice. In natura, può essere trovato nello stato legato sotto forma di sali di sodio, magnesio e potassio, il loro contenuto in acqua di mare è particolarmente alto. Alcuni tipi di alghe brune e rosse: sargassum, fucus, batrachospermum, contengono grandi quantità di bromo e iodio.

Reazioni con sostanze semplici
L'elemento è caratterizzato dall'interazione con molti non metalli: zolfo, fosforo, idrogeno:
Br 2 + H 2 = 2HBr
Tuttavia, il bromo non reagisce direttamente con azoto, carbonio e ossigeno. La maggior parte dei metalli è facilmente ossidata dal bromo. Solo alcuni di essi sono passivi all'azione alogena, ad esempio piombo, argento e platino. Le reazioni con il bromo di alogeni più attivi, come il fluoro e il cloro, passano velocemente:
Ad
Br 2 + 3 F 2 = 2 BrF 3
Nell'ultima reazione stato di ossidazione l'elemento è +3, agisce come agente riducente. Nell'industria, il bromo viene prodotto ossidando il bromuro di idrogeno con un alogeno più forte, ad esempio il cloro. Le principali fonti di materie prime per la produzione di composti sono le acque sotterranee di perforazione, nonché una soluzione altamente concentrata di laghi salati. L'alogeno può interagire con sostanze complesse della classe dei sali medi. Quindi, sotto l'azione dell'acqua di bromo, che ha un colore rosso-marrone, sulla soluzione di solfito di sodio, osserviamo una decolorazione della soluzione. Ciò è dovuto all'ossidazione da parte del bromo di un sale - solfito medio a solfato di sodio. Lo stesso alogeno viene ridotto, trasformandosi nella forma di acido bromidrico, che non ha colore.
Ad

Interazione con composti organici
Br 2 molecole sono in grado di interagire non solo con semplici, ma anche con sostanze complesse. Ad esempio, la reazione di sostituzione avviene tra un idrocarburo aromatico, benzene e bromo quando riscaldato, in presenza di un catalizzatore - bromuro ferrico. Termina con la formazione di un composto incolore, insolubile in acqua - bromobenzene:
C 6 H 6 + Br 2 = C 6 H 5 Br + HBr
La semplice sostanza bromo, disciolta in acqua, viene utilizzata come indicatore per determinare la presenza nella molecola materia organica legami insaturi tra gli atomi di carbonio. tale risposta qualitativa trova nelle molecole di alcheni o alchini pi-legami, da cui dipendono le principali reazioni chimiche di questi idrocarburi. Il composto entra in reazioni di sostituzione con idrocarburi saturi, formando così derivati di metano, etano e altri alcani. La reazione di addizione di particelle di bromo, la cui formula è Br2, a sostanze insature con uno o due legami doppio o triplo in molecole, per esempio, come etene, acetilene o butadiene, è nota.
Ad
CH 2 = CH 2 + Br 2 = CH 2 Br - CH 2 Br
Non solo una semplice sostanza può reagire con questi idrocarburi, ma anche il suo composto di idrogeno - HBr.
Caratteristiche dell'interazione tra alogeno e fenolo
Il materiale organico costituito da un anello benzenico legato a un gruppo idrossile è il fenolo. L'influenza reciproca di gruppi di atomi l'uno sull'altro è tracciata nella sua molecola. Pertanto, le reazioni di sostituzione con alogeni sono molto più veloci per lui che per il benzene. Inoltre, il processo non richiede il riscaldamento e la presenza di un catalizzatore. Immediatamente, tre atomi di idrogeno nella molecola di fenolo vengono sostituiti da radicali di bromo. Il tribromfenolo si forma come risultato della reazione.

Composti di ossigeno bromo
Continuiamo lo studio di cosa sia il bromo. L'interazione di alogeno con acqua fredda si traduce in acido ipobromico HBrO. È più debole del composto di cloro a causa di una diminuzione delle sue proprietà ossidanti. Un altro composto, l'acido bromico, può essere ottenuto ossidando l'acqua di bromo con il cloro. Precedentemente in chimica, si riteneva che il bromo non potesse avere composti in cui potesse mostrare uno stato di ossidazione di +7. Tuttavia, mediante l'ossidazione del bromuro di potassio, è stato ottenuto il sale, bromato di potassio, e da esso l'acido corrispondente, HBrO 4 . Gli ioni alogeni hanno proprietà riducenti: sotto l'azione delle molecole HBr sui metalli, questi ultimi vengono ossidati dai cationi dell'idrogeno. Pertanto, solo quegli elementi metallici interagiscono con l'acido, che sono tra le attività fino all'idrogeno. Come risultato della reazione, si formano sali medi, bromuri e viene liberato idrogeno libero.
Uso di composti di bromo
L'elevata capacità ossidante del bromo, la cui massa è abbastanza grande, è ampiamente usata nella chimica analitica, così come nella chimica di sintesi organica. In agricoltura, preparati contenenti bromo, utilizzati nella lotta contro le erbe infestanti e gli insetti - parassiti. I ritardanti di fiamma - sostanze che impediscono la combustione spontanea, sono utilizzati per impregnare materiali da costruzione, materie plastiche e tessuti. In medicina, l'effetto inibitorio dei sali, del potassio e del bromuro di sodio, sul passaggio degli impulsi bioelettrici lungo le fibre nervose è noto da tempo. Sono utilizzati nel trattamento dei disturbi del sistema nervoso: isteria, nevrastenia, epilessia. Data la forte tossicità dei composti, il dosaggio del farmaco deve essere monitorato da un medico.
Nel nostro articolo abbiamo scoperto cos'è il bromo e quali proprietà fisiche e chimiche sono caratteristiche di esso.