Ossido di zolfo in natura e vita umana
In questo articolo troverai informazioni su cosa sia l'ossido di zolfo. Saranno prese in considerazione le sue proprietà di base di natura chimica e fisica, le forme esistenti, i metodi per la loro preparazione e le differenze tra loro. Inoltre, saranno menzionati i campi di applicazione e il ruolo biologico di questo ossido nelle sue varie forme.
Qual è la sostanza
L'ossido di zolfo è un composto di sostanze semplici, zolfo e ossigeno. Esistono tre forme di ossidi di zolfo, che differiscono nel grado di valenza indicata S, vale a dire: SO (monossido, monossido di zolfo), SO 2 (biossido di zolfo o biossido di zolfo) e SO 3 (triossido di zolfo o anidride solforosa). Tutte le variazioni elencate degli ossidi di zolfo hanno caratteristiche chimiche e fisiche simili.
Ad

Informazioni generali sul monossido di zolfo
Il monossido di zolfo bivalente o monossido di zolfo è sostanza inorganica composto da due elementi semplici: zolfo e ossigeno. La formula è COSÌ. In condizioni normali, è un gas senza colore, ma con un odore acuto e specifico. Reagisce con una soluzione acquosa. Un composto piuttosto raro nell'atmosfera terrestre. Per gli effetti della temperatura è instabile, esiste in forma dimerica - S 2 O 2 . A volte in grado, interagendo con l'ossigeno, a seguito della reazione di formare anidride solforosa. Il sale non si forma.
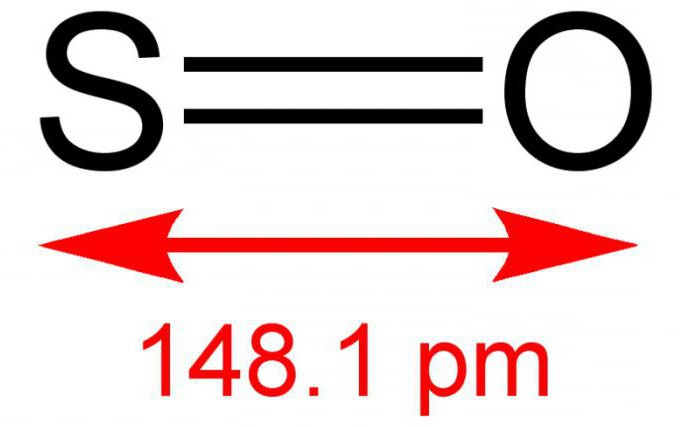
L'ossido di zolfo (2) si ottiene solitamente bruciando lo zolfo o decomprimendo la sua anidride:
- 2S2 + O 2 = 2SO;
- 2SO2 = 2SO + O2.
La sostanza si dissolve in acqua. Di conseguenza, l'ossido di zolfo forma l'acido tiosolfurico:
- S 2 O 2 + H 2 O = H 2 S 2 O 3 .
Informazioni generali sul biossido di zolfo
L'ossido di zolfo è un'altra forma di ossidi di zolfo con la formula chimica SO 2 . Ha un odore sgradevole e non ha colore. Sotto pressione, può accendersi a temperatura ambiente. Quando si scioglie in acqua forma instabile acido solforico. Può essere sciolto in soluzioni di etanolo e acido solforico. È un componente del gas vulcanico.
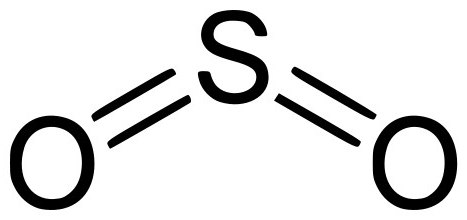
L'industria è prodotta bruciando zolfo o bruciando i suoi solfuri:
- 2FeS 2 + 5O 2 = 2FeO + 4SO 2 .
Nei laboratori, di regola, l'SO 2 si ottiene con l'aiuto di solfiti e idrosolfiti, esponendoli a acidi forti, nonché a metalli con un piccolo grado di attività di H 2 SO 4 concentrato.
Come altri ossidi di zolfo, SO 2 è ossido acido. Interagendo con alcali, formando vari solfiti, reagisce con l'acqua, creando acido solforico.
SO 2 è estremamente attivo, e questo è chiaramente espresso nelle sue proprietà riducenti, dove aumenta il grado di ossidazione dell'ossido di zolfo. Può presentare proprietà ossidanti se esposto a un forte agente riducente. Quest'ultima caratteristica è utilizzata per la produzione di acido ipofosforoso o per la separazione di S dai gas del campo di attività metallurgico.
Ad
L'ossido di zolfo (4) è ampiamente utilizzato dall'uomo per la produzione di acido solforico o suoi sali - questo è il suo principale campo di applicazione. Partecipa anche ai processi di vinificazione e fa da conservante (E220), a volte viene utilizzato per il deposito di magazzini e magazzini di verdure, poiché distrugge i microrganismi. I materiali che non possono essere sbiancati con cloro sono trattati con ossido di zolfo.

SO 2 è un composto abbastanza tossico. I sintomi caratteristici che indicano l'avvelenamento sono la tosse, la comparsa di problemi respiratori, di solito sotto forma di naso che cola, raucedine, l'aspetto di un gusto insolito e un mal di gola. L'inalazione di tale gas può causare soffocamento, compromissione della capacità di parlare del soggetto, vomito, difficoltà a deglutire e edema polmonare in forma acuta. La concentrazione massima ammissibile di questa sostanza in laboratorio è 10 mg / m 3 . Tuttavia, in persone diverse, il corpo può mostrare sensibilità diverse anidride solforosa.
Ad
Dati generali sull'anidride solforica
Il diossido di zolfo, o anidride solforosa come viene chiamato, è il più alto ossido di zolfo con la formula chimica SO 3 . Liquido con un odore soffocante, altamente volatile in condizioni standard. In grado di congelare, formando una miscela del tipo cristallino delle sue modificazioni solide, ad una temperatura di 16,9 ° C e inferiore.
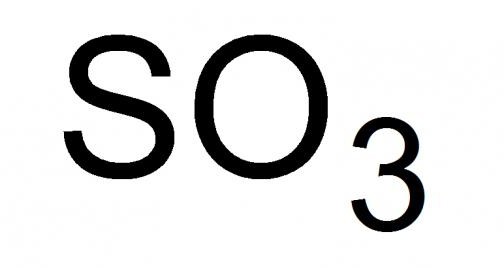
Analisi dettagliata dell'ossido più alto
Quando SO 2 viene ossidato dall'aria a temperature elevate, una condizione necessaria è la presenza di un catalizzatore, ad esempio V 2 O 5 , Fe 2 O 3 , NaVO 3 o Pt.
Decomposizione termica dei solfati o interazione di ozono e SO 2 :
- Fe 2 (SO 4 ) 3 = Fe 2 O 3 + 3SO 3 ;
- SO 2 + O 3 = SO 3 + O 2 .
Ossidazione di SO 2 con NO 2 :
- SO 2 + NO 2 = SO 3 + NO.
Le caratteristiche qualitative fisiche includono: la presenza di una struttura piatta, tipo trigonale e simmetria D 3 h nello stato del gas, durante il passaggio da gas a cristallo o forma liquida un trimero di natura ciclica e una catena a zigzag, ha un legame polare covalente.
In forma solida, SO 3 si trova nelle forme alfa, beta, gamma e sigma, mentre ha, rispettivamente, un diverso punto di fusione, grado di polimerizzazione e una varietà di forme cristalline. L'esistenza di un tale numero di tipi di SO 3 è dovuta alla formazione di legami di tipo donatore-accettore.
Ad
Le proprietà dell'anidride solforosa includono molte delle sue qualità, le principali sono:
Capacità di interagire con basi e ossidi:
- 2KHO + SO 3 = K 2 SO 4 + H 2 O;
- CaO + SO 3 = CaSO 4 .
Il più alto ossido solforico SO 3 ha un'attività piuttosto grande e crea acido solforico, interagendo con l'acqua:
- SO 3 + H 2 O = H2SO 4.
Reagisce con l'acido cloridrico e forma l'acido clorosolfato:
- SO 3 + HCl = HSO 3 Cl.
Per la caratteristica ossido di zolfo è la manifestazione di forti proprietà ossidanti.
L'uso di anidride solforica è nella creazione di acido solforico. Una piccola quantità di esso viene rilasciato nell'ambiente durante l'uso di dama di zolfo. SO 3 , formando acido solforico dopo aver interagito con una superficie bagnata, distrugge una varietà di organismi pericolosi, come i funghi.
Riassumendo
L'ossido di zolfo può essere in diversi stati aggregativi, a partire da un liquido e termina con una forma solida. Raramente si trova in natura e ci sono diversi modi per ottenerlo nell'industria, così come sfere in cui può essere usato. L'ossido stesso ha tre forme in cui esibisce vari gradi di valenza. Può essere molto tossico e causare seri problemi di salute.