L'atomo di carbonio: struttura, caratteristiche e proprietà
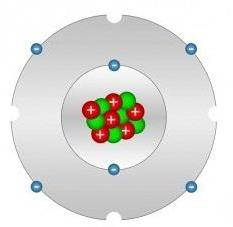
In questo articolo, consideriamo un elemento che fa parte della tavola periodica D.I. Mendeleev, vale a dire il carbonio. Nella moderna nomenclatura, è denotato dal simbolo C, è nel quattordicesimo gruppo ed è il "partecipante" del secondo periodo, ha un sesto numero di sequenza e il suo amu. = 12.0107.
Orbitali atomici e loro ibridazione
Iniziamo a considerare il carbonio dai suoi orbitali e la loro ibridazione - le sue caratteristiche principali, grazie alle quali ancora si meravigliano gli scienziati di tutto il mondo. Qual è la loro struttura?
L'ibridizzazione dell'atomo di carbonio è organizzata in modo tale che gli elettroni di valenza occupino posizioni su tre orbitali, vale a dire: uno è sugli orbitali 2s, e due è su 2p-orbitali. Gli ultimi due dei tre orbitali formano un angolo uguale a 90 gradi l'uno rispetto all'altro e l'orbita 2s ha una simmetria sferica. Tuttavia, questa forma del dispositivo degli orbitali considerati non ci permette di capire perché il carbonio, entrando in composti organici forma angoli di 120, 180 e 109,5 gradi. La formula per la struttura elettronica di un atomo di carbonio si esprime come segue: (He) 2s 2 2p 2 .
La risoluzione della contraddizione risultante è stata fatta introducendo il concetto di ibridazione degli orbitali atomici. Per comprendere la natura triedrica e variante di C, era necessario creare tre forme di comprensione della sua ibridazione. Il principale contributo all'emergenza e allo sviluppo di questo concetto è stato fatto da Linus Pauling.
Proprietà fisiche
La struttura dell'atomo di carbonio determina la presenza di un certo numero di determinate caratteristiche di natura fisica. Gli atomi di questo elemento formano una sostanza semplice: il carbonio, che ha delle modifiche. Variazioni nei cambiamenti della sua struttura possono conferire alla sostanza formata caratteristiche qualitative diverse. La ragione della presenza di un gran numero di modifiche del carbonio sta nella sua capacità di stabilire e formare legami eterogenei di natura chimica.
La struttura dell'atomo di carbonio può variare, il che gli consente di avere un certo numero di forme isotopiche. Il carbonio trovato in natura si forma con l'aiuto di due isotopi in uno stato stabile - 12 C e 13 C - e un isotopo con proprietà radioattive - 14 C. L'ultimo isotopo è concentrato negli strati superiori della crosta terrestre e nell'atmosfera. A causa dell'influenza della radiazione cosmica, vale a dire dei suoi neutroni, sul nucleo degli atomi di azoto, un isotopo radioattivo di 14 C. bomba all'idrogeno. Il metodo di datazione al radiocarbonio, che ha trovato ampia applicazione in archeologia e geologia, si basa sul processo di decadimento del 14 ° C.
Modifica del carbonio in forma allotropica
In natura, ci sono molte sostanze che contengono carbonio. L'uomo utilizza la struttura dell'atomo di carbonio per i propri scopi quando crea varie sostanze, tra cui:
- Carboni di cristallo (diamanti, nanotubi di carbonio, fibre e fili, fullereni, ecc.).
- Carboni amorfi (attivato e carbone, vari tipi di coke, nerofumo, fuliggine, nanofoamo e antracite).
- Forme a grappolo di carbonio (composti di-carbonio, nanocono e astralene).
Caratteristiche strutturali della struttura atomica
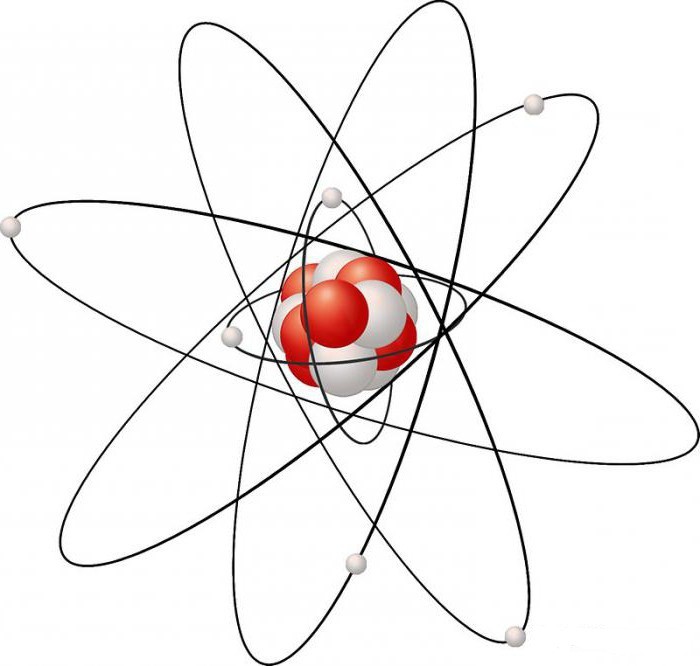
La struttura elettronica di un atomo di carbonio può avere una geometria diversa, che dipende dal livello di ibridazione degli orbitali che possiede. Esistono 3 tipi principali di geometria:
- Tetraedrico - è creato a causa dello spostamento di quattro elettroni, uno dei quali è s-, e tre appartengono agli elettroni p. L'atomo C occupa una posizione centrale nel tetraedro ed è collegato da quattro legami sigma equivalenti con altri atomi che occupano il vertice di questo tetraedro. Con una tale disposizione geometrica di carbonio, le sue forme allotropiche possono formare, ad esempio, diamante e lonsdaleite.
- Trigonal - deve il suo aspetto allo spostamento di tre orbitali, di cui uno è s- e due p-. Qui ci sono tre legami sigma che sono in posizione uguale l'uno con l'altro; giacciono su un piano comune e aderiscono a un angolo di 120 gradi l'uno rispetto all'altro. L'orbitale p libero si trova perpendicolare al piano del sigma-legame. La grafite ha una geometria simile.
- Diagonale - appare a causa della miscelazione di elettroni s e p (ibridazione sp). Le nuvole di elettroni sono disegnate lungo la direzione generale e prendono la forma di un manubrio asimmetrico. Gli elettroni liberi creano legami π. Questa struttura della geometria in carbonio dà origine all'aspetto del carbyne, una forma speciale di modifica.
Atomi di carbonio in natura
La struttura e le proprietà dell'atomo di carbonio sono state a lungo considerate dall'uomo e vengono utilizzate per ottenere un gran numero di varie sostanze. Gli atomi di questo elemento, grazie alla loro capacità unica di formare legami chimici diversi e alla presenza di ibridazione di orbitali, creano molte diverse modifiche allotropiche con la partecipazione di un solo elemento, da atomi dello stesso tipo, carbonio.

In natura, il carbonio si trova nella crosta terrestre; si presenta sotto forma di diamanti, grafite, varie risorse naturali combustibili, come olio, antracite, carbone marrone, scisto, torba, ecc. Incluso nei gas utilizzati dall'uomo nell'industria energetica. Il carbonio nella composizione del suo diossido riempie l'idrosfera e l'atmosfera della Terra, e nell'aria raggiunge lo 0,046%, e nell'acqua - fino a sessanta volte di più.
Nel corpo umano, C è contenuto in una quantità approssimativamente uguale al 21%, ed è principalmente escreto nelle urine e nell'aria espirata. Lo stesso elemento è coinvolto nel ciclo biologico, viene assorbito dalle piante e consumato durante la fotosintesi.
Gli atomi di carbonio, grazie alla loro capacità di stabilire vari legami covalenti e costruire catene di essi, e persino cicli, possono creare un'enorme quantità di sostanze di natura organica. Inoltre, questo elemento fa parte dell'atmosfera solare, essendo in composti con idrogeno e azoto.
Proprietà chimiche

Consideriamo ora la struttura e le proprietà dell'atomo di carbonio da un punto di vista chimico.
È importante sapere che il carbonio esibisce proprietà inerti in normali condizioni di temperatura, ma può mostrarci proprietà di natura riducente sotto l'influenza di alte temperature. principale stati di ossidazione: + - 4, a volte +2, e anche +3.
Partecipa alla reazione con un gran numero di elementi. Può reagire con acqua, idrogeno, alogeni, metalli alcalini acidi, fluoro, zolfo, ecc.
La struttura dell'atomo di carbonio genera un'enorme quantità di sostanze separate in una classe separata. Tali composti sono chiamati organici e sono basati su C. È possibile a causa della proprietà degli atomi di questo elemento di formare catene polimeriche. Tra i gruppi più famosi ed estesi vi sono proteine (proteine), grassi, carboidrati e composti idrocarburici.
Metodi operativi
A causa della struttura unica dell'atomo di carbonio e delle sue proprietà, l'elemento è ampiamente utilizzato dagli esseri umani, ad esempio, quando si creano matite, fondendo crogioli di metallo - qui si usa la grafite. I diamanti sono usati come materiali abrasivi, gioielli, ugelli per trapani, ecc.
Farmacologia e medicina sono anche coinvolte nell'uso del carbonio in una varietà di composti. Questo elemento è parte dell'acciaio, serve come base per ciascuno materia organica partecipa al processo di fotosintesi, ecc.
Tossicità dell'elemento

La struttura dell'atomo di carbonio contiene la presenza di un effetto pericoloso sulla materia vivente. Il carbonio entra nel mondo intorno a noi come risultato della combustione del carbone nelle centrali termiche, fa parte dei gas prodotti dalle automobili, nel caso del concentrato di carbone, ecc.
Un'alta percentuale di carbonio negli aerosol, che comporta un aumento dell'incidenza delle persone. Le vie aeree superiori e i polmoni sono più comunemente colpiti. Alcune malattie possono essere classificate come professionali, ad esempio, bronchiti della polvere e malattie del gruppo di pneumoconiosi.
14 C è tossico e la forza della sua influenza è determinata dall'interazione radiativa con le particelle β. Questo atomo fa parte della composizione delle molecole biologiche, comprese quelle contenute negli acidi deossi e ribonucleici. La quantità ammissibile di 14 C nell'aria dell'area di lavoro è considerata pari a 1,3 Bq / l. La quantità massima di carbonio che entra nel corpo durante la respirazione è pari a 3,2 * 10 8 Bq / anno.